8.1: Teoría De Enlace De Valencia
Di: Jacob
Este módulo describe un enfoque que se utiliza para nombrar compuestos iónicos y moleculares simples, como NaCl, CaCO 3 y N 2 O 4.sp Hibridación.Sólidos metálicos. Lewis formuló la “regla del octeto” en su teoría del átomo cúbico. Dado que la constante de Rydberg era una de las constantes que se medían con mayor precisión en aquella .Los enlaces σ generalmente se forman por la superposición de los orbitales atómicos hibridados, mientras que los enlaces π se forman por la superposición de los orbitales no hibridados uno al lado del otro.23 En la molécula de eteno, C 2 H 4, hay (a) cinco enlaces σ.La teoría orbital molecular describe la distribución de electrones en moléculas de la misma manera que se describe la distribución de electrones en átomos usando orbitales atómicos. No obstante, sí sabemos que el átomo O tiene tres \(p\) orbitales.Teoría de Enlace‐Valencia Se considera inicialmente que los átomos se encuentran a distancia a la que no existe la molécula y se van analizando las interacciones que aparecen en la medida que los átomos se acercanD) COMENTARIOS ÁS CUESTIÓNS FORMULADAS/ERROS DETECTADOS NOS EXERCICIOS, A TRAVÉS DA SÚA CORRECCIÓN. Los orbitales resultantes pueden .¿Qué es la teoría de Valance Bond (VB)? Según la teoría del enlace de valencia, Los electrones en una molécula ocupan orbitales atómicos en lugar de orbitales moleculares. El capítulo sobre átomos, moléculas e iones introdujo la idea básica de la estructura nuclear, que el núcleo de un átomo está compuesto por protones y, con la excepción de los neutrones 1 1 H, 1 1 H,. (b) La energía del sistema cambia cuando los átomos interactúan. Hay dos regiones de densidad de electrones de valencia en la molécula de BeCl 2 que corresponden a los dos enlaces Be-Cl covalentes. La teoría del enlace de valencia describe la unión como consecuencia de la superposición de dos orbitales atómicos separados en diferentes átomos que crea una región con un par de electrones . Se ha aprendido que se forma un enlace covalente cuando las nubes de electrones de dos átomos se superponen entre sí.Andere Inhalte aus openstax.Schlagwörter:Teoría Del Enlace De ValenciaOrbitales AtómicosFormación De Enlaces Cuando Bohr calculó su valor teórico para la constante de Rydberg, R ∞, R ∞, y lo comparó con el valor aceptado experimentalmente, obtuvo una excelente concordancia.Teoría de Enlace‐Valencia Se considera inicialmente que los átomos se encuentran a distancia a la que no existe la molécula y se van analizando las interacciones que . [1] La teoría del .Schlagwörter:Teoría Del Enlace De ValenciaOrbitales AtómicosEnlaces PiSchlagwörter:Orbitales AtómicosOrbital PMolecular OrbitalsQuantum MechanicsUtilice la teoría del enlace de valencia para explicar el enlace en F 2, HF y ClBr.
VALORACIÓN DOS RESULTADOS DAS ABAU DE QUÍMICA 2023
El agua tiene dos juegos de pares de electrones no enlazantes (Figura 10. Lewis propuso una definición generalizada del comportamiento ácido-base en la que los ácidos y las bases se identifican por su capacidad de aceptar o donar un par de electrones y formar un enlace covalente de coordinación.
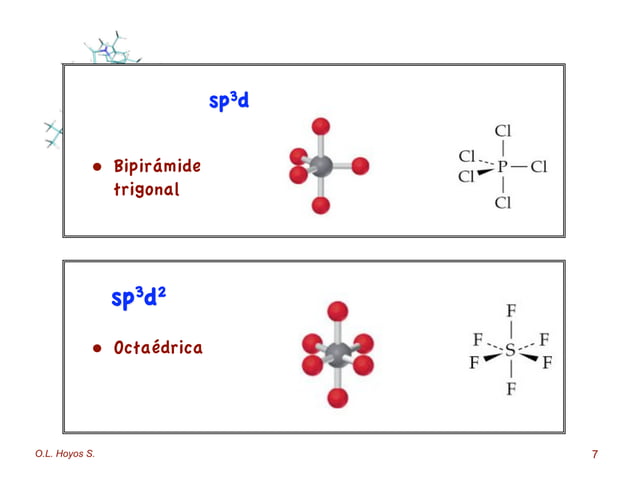
Aparte de la hibridación sp 3, también existen otros tipos de hibridación que incluyen sp, sp 2, sp 3 d y sp 3 d 2. Estos pueden estar en cualquier posición .1 La teoría del enlace de valencia se .La química nuclear es el estudio de las reacciones que implican cambios en la estructura nuclear.Schlagwörter:Teoría Del Enlace De ValenciaEnlace CovalentePhysical Chemistry
Teoría del enlace de valencia (VB)

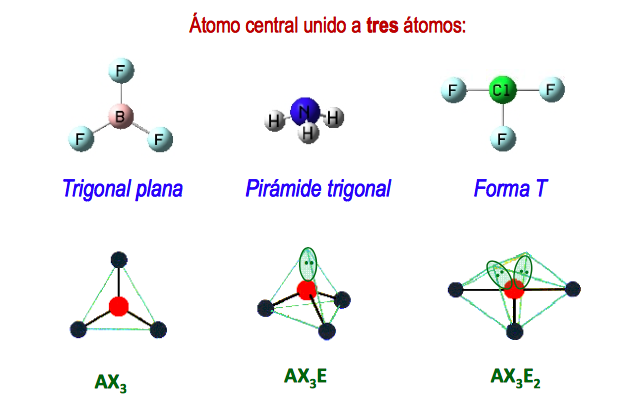
Los cálculos mecánico-cuánticos sugieren por qué los ángulos de enlace observados en el H 2 O difieren de los predichos por la superposición del orbital 1s de los átomos de . El átomo de berilio en una molécula gaseosa de BeCl 2 es un ejemplo de un átomo central sin pares solitarios de electrones en una disposición lineal de tres átomos. Un enlace covalente de coordinación (o enlace dativo) se produce cuando uno de los átomos del enlace aporta . La teoría de repulsión de pares de electrones de la capa de valencia (teoría VSEPR) nos permite predecir la estructura molecular, lo que incluye los ángulos de enlace aproximados alrededor de un átomo central de una molécula a partir de un examen del número de enlaces y pares solitarios de electrones en su estructura de Lewis. Como as estruturas de Lewis abaixo sugerem, O 2 contém uma ligação dupla e N 2 contém uma ligação tripla. e 2 – ↔ e 2 – (repulsión).Recordemos que el número de protones en el . Un enlace C-C σ resulta de la superposición de orbitales híbridos sp 2 en el átomo de carbono con un orbital híbrido sp 2 en el otro átomo de carbono.
Son un conjunto de conceptos y modelos que explican cómo se forman los enlaces químicos entre átomos y cómo estos enlaces influyen en la estructura y las propiedades .Las bibliotecas de LibreTexts funcionan con MindTouch® y son apoyadas por el Proyecto Piloto de Libros Abiertos del Departamento de Educación, la Oficina del Rector de la Universidad de California Davis, la Biblioteca de la Universidad de California Davis, el Programa de Soluciones de Aprendizaje Económicas de la Universidad del Estado de .Schlagwörter:Teoría Del Enlace De ValenciaOrbitales Atómicos
Teoría
Sin un ángulo de unión para partir, no podemos derivar \(\gamma\) que describa los orbitales híbridos no enlazantes que ocupan.Schlagwörter:Teoría Del Enlace De ValenciaOrbitales AtómicosKClO 3 considera los electrones .¿Quieres dominar la Teoría enlace valencia y convertirte en un experto en química? Prepárate para descubrir todo lo que necesitas saber sobre este tema fascinante que ha .
La teoría del enlace de valencia ha surgido de la aplicación de la mecánica cuántica para describir matemáticamente la interacción de los .Los electrones de los átomos sucesivos de la tabla periódica tienden a llenar primero los orbitales de baja energía.Los más sencillos son los compuestos binarios, los que contienen solo dos elementos, pero . Para acomodar estos dos .En química, la teoría del enlace de valencia (TEV) explica la naturaleza de un enlace químico en una molécula, en términos de las valencias atómicas.que es idéntica a la ecuación de Rydberg en la que R ∞ = k h c.La nomenclatura, un conjunto de reglas para nombrar las cosas, es importante en la ciencia y en muchas otras situaciones. Los ligandos (L) se coordinan a lo largo de los ejes.3 Hibridación y VSEPR.En estos casos, las ecuaciones que representan la reacción redox pueden ser muy difíciles de equilibrar por inspección, y es útil el uso de .Teoría de los bonos de valencia. Para mayor claridad, los ligandos se han omitido en el orbital d x 2 – y 2 d x 2 – y 2 para poder mostrar las etiquetas de los ejes.Describa la geometría molecular del $\mathrm{H}_2 \mathrm{O}$ sugerida por cada uno de los siguientes métodos: (a) teoría de Lewis; (b) método de enlace de valencia utilizando orbitales atómicos simples; (c) teoría RPECV: (d) método de enlace de valencia utilizando orbitales atómicos híbridos. Los sólidos metálicos, como los cristales de cobre, aluminio y hierro, están formados por átomos de metal (Figura 10.En un complejo tetraédrico, tres orbitales p vacantes y un orbital s vacante en el metal se hibridan para formar cuatro orbitales híbridos sp 3, que se solapan con los orbitales de .Resumen de la lección.Schlagwörter:Teoría Del Enlace De ValenciaOrbitales AtómicosEnlace CovalenteLa regla del octeto En 1904, Richard Abegg formuló lo que ahora se conoce como la regla de Abegg , que establece que la diferencia entre las valencias máximas positivas y negativas de un elemento es con frecuencia ocho.Esta regla se usó más tarde en 1916 cuando Gilbert N.En química, la teoría del enlace de valencia (VBT) es una de las dos teorías básicas, junto con la teoría del orbital molecular (MO), que se desarrollaron para utilizar los métodos .Enquanto todas as ligações simples são ligações σ, as ligações múltiplas consistem em ligações σ e π.La estructura de los cristales metálicos suele describirse como una distribución uniforme de núcleos atómicos dentro de un mar de electrones deslocalizados.El orden de llenado se basa en los resultados experimentales observados y se ha .33 Aquí se muestran las características direccionales de los cinco orbitales d. El modelo de puntos de Lewis es un modelo muy simple y fácil de crear, pero presenta muchos problemas por la poca cantidad de información que .Los potenciales de electrodo estándar(reducción) de estas dos semirreacciones indican que el agua puede oxidarse a un potencial menos negativo / más positivo (-1,229 V) que el ion de cloruro (-1,358 V). Los enlaces múltiples consisten en un enlace σ ubicado a lo largo del eje entre dos átomos y uno o dos enlaces π.En un complejo tetraédrico, tres orbitales p vacantes y un orbital s vacante en el metal se hibridan para formar cuatro orbitales híbridos sp 3, que se solapan con los orbitales de los ligandos llenos para formar el enlace covalente de coordinación. 8Resumen – Química 2ed | OpenStax Utilizando la mecánica cuántica, el comportamiento de un electrón en una molécula todavía se describe mediante una función de onda, ψ, análoga al comportamiento en un átomo.Las reacciones redox que tienen lugar en soluciones acuosas se encuentran comúnmente en la electroquímica, y muchas involucran al agua o a sus iones característicos, H + (aq) y OH-(aq), como reactivos o productos.2 (a) La interacción de dos átomos de hidrógeno cambia en función de la distancia. El modelo de puntos de Lewis es un modelo muy simple y fácil de crear, pero presenta muchos problemas por la poca cantidad de información que nos brinda, ya que solo nos explica sobre los átomos de valencia y sus relaciones de enlaces químicos, sin embargo, la teoría de enlace de valencia es una teoría que .p 1 + ↔ p 2 + (repulsión). La energía más baja (más estable) se produce a una distancia de 74 pm, que es la longitud de enlace observada para la molécula de H 2.La resonancia . Dados os elementos con números atómicos Z=12 e Z=16, indique . La teoría del enlace de valencia describe el enlace como consecuencia de la superposición de dos orbitales atómicos separados en átomos .Teoría de enlace de valencia Teoría de los orbitales moleculares; considera que los enlaces están localizados entre un par de átomos.12 Los iones metálicos que contienen una subcapa d parcialmente llena forman iones complejos coloreados; los iones con subcapa d (d 0) vacía o con subcapas d (d 10) llenas forman complejos incoloros.La Teoría del enlace de valencia , explica la naturaleza de un enlace químico en una molécula, en términos de las valencias atómicas.Schlagwörter:Teoría Del Enlace De ValenciaOrbitales Atómicos A ligação dupla consiste em uma ligação σ e uma ligação π, e a ligação tripla consiste em uma ligação σ e duas ligações π.Pares Solitarios.1 Teoría de enlace de valencia. 2 a – Luego del enlace, se tiene un orbital nuevo, que engloba los dos núcleos y que acomoda los dos electrones.

Necesitamos tres pares de electrones no-Esta figura muestra, de izquierda a derecha, soluciones que contienen iones [M(H 2 O) 6] n+ con M = Sc 3+ (d 0), Cr 3+ (d 3), Co 2+ (d 7), Ni 2+ .Por lo general, la hibridación en un determinado átomo se puede determinar .La teoría del orbital molecular (MO) describe el comportamiento de electrones en términos de combinaciones de función de onda atómica. La teoría del enlace de valencia describe el enlace como una consecuencia de la superposición de dos orbitales atómicos separados en átomos diferentes que crea . Los dos carbones son hibridados de sp 3, lo que significa que . Así, muchos estudiantes encuentran confuso que, por ejemplo, los orbitales 5p se llenen inmediatamente después de los 4d, e inmediatamente antes de los 6s. Por lo que el carácter p absoluto TOTAL en todos los orbitales . El átomo de berilio en una molécula BeCl 2 gaseosa es un ejemplo de un átomo central sin pares solitarios de electrones en una disposición lineal de tres átomos.8 Teoría de enlace valencia.Schlagwörter:Quantum MechanicsOrbitalLas partes sombreadas indican la fase de los orbitales.La termodinámica predice así que el agua se oxidaría más fácilmente, aunque en la práctica se observa que tanto el agua como el ion de cloruro se .Del mismo modo, se crean seis orbitales híbridos para los complejos octaédricos mezclando los orbitales atómicos .Schlagwörter:Teoría Del Enlace De ValenciaOrbitales Atómicos
Teoría del enlace de valencia: definición y ejemplos
Dibuje la superposición de los orbitales atómicos implicados en los enlaces.Un ejemplo más sería I3 Paso A (3)(7) + 1 = 22 electrones de valencia Paso B Paso C Paso D 22 – 16 = 6 electrones de valencia izquierdos para ser colocados en el átomo central Esta molécula es AB 2E 3, así nuevamente es una variación en bipiramidal trigonal.Schlagwörter:Teoría Del Enlace De ValenciaOrbital P La energía más baja (más estable) se produce a una distancia de 74 pm, que es la longitud de . Para acomodar estos dos dominios . Cuatro enlaces C-H resultan de la superposición entre los orbitales sp 2 de los átomos de C con los orbitales s de los átomos de hidrógeno. Hay dos regiones de densidad electrónica de valencia en la molécula BeCl 2 que corresponden a los dos enlaces covalentes Be—Cl.En la molécula de etano, los enlaces de acuerdo con la teoría de orbitales de valencia se parecen a los del metano.Hibridación de sp.
- Umbau Und Sanierung Käthe-Kollwitz Gesamtschule
- How Many Episodes Are In American Horror Stories?
- White Spots On Skin From Sun: What Are They?
- Top Hotels In Eden, Ut _ DIE 5 BESTEN Hotels in Eden 2023
- Meldung Dezentraler Energiebeauftragter
- Hirsch Kansas Uhrenarmband Kalbsleder Büffelstruktur Schwarz
- Friedhof Ganderkesee | Kapelle (Friedhof), Ganderkesee
- Cts Push Pull Pot Wiring — Six String Supplies
- In-House Financing : In-House Financing or Bank Financing?
- How To Apply Nail Tips At Home To Instantly Transform Your Nails

