Elektrolyse Pb2 Erklärung | Elektrolyse als erzwungene Redoxreaktion
Di: Jacob
Sie könnte in Zukunft im Rahmen einer Wasserstoffwirtschaft an Bedeutung gewinnen.deEmpfohlen auf der Grundlage der beliebten • Feedback
Elektrolyse als erzwungene Redoxreaktion
So kann Wasser elektrolysiert werden, indem man zwei Platinelektroden in verdünnte Schwefelsäure oder Kalilauge taucht und von außen eine entsprechende . der Elektrolyse, welche auf die Moleküle selbst zurückgreifen. Sie wird beispielsweise zur Gewinnung von Metallen verwendet, . Die chemische Zersetzung dieser Elektrolyten durch den Stromfluss bezeichnet man als Elektrolyse.
Elektrolyse einfach erklärt
Bleiakkumulator für Kraftfahrzeuge. Die Elektrolyse von Wasser besteht aus zwei Teilreaktionen, die an den beiden Elektroden (Kathoden- und Anodenräumen) ablaufen. störender Kationen bei der Bestimmung von Anionen. (00:40) Schauen wir uns ein Beispiel für eine Redoxreaktion an: Zuerst betrachten wir die Gesamtreaktion, die wir dann in die Teilreaktionen aufteilen. Dabei gibt es auch Verfahren von z. Diese chemische Zersetzung mit Hilfe eines elektrischen Gleichstroms bezeichnet man als Elektrolyse. Beispielsweise kann man mittels Elektrolyse von . Die chemische Wirkung des Stroms, die sogenannte Elektrolyse, hat heute eine große technische Bedeutung.Im Protonen-Austausch-Membran -Elektrolyseur wird destilliertes Wasser durch elektrischen Strom in Wasserstoff und Sauerstoff gespalten. Diese Form der Elektrolyse wird auch als „Wasserelektrolyse“ bezeichnet.Elektrolyse nennt man einen chemischen Prozess, bei dem elektrischer Strom eine Redoxreaktion erzwingt.Elektrolyse von Wasser – eine einfache Erklärung. Die Elektrolyse ist die Umkehrung galvanischer Prozesse durch Verrichten elektrischer Arbeit. Frauen machen sich ihre Macht zu eigen, indem sie sich weigern, ihre Körperbehaarung zu entfernen, und sie in . „Für den Fall, dass etwas ausläuft, gibt es auch . Vergleiche die galvanische Zelle mit der Elektrolyse-Zelle anhand der Zinkbromid-Zelle.Vorwissen:Galvanische Zellen: https://youtu. Meine Frage hab ich schon oben geschrieben, aber ich erklär das nochmal genauer.Mit Hilfe von elektrischem Strom können einige Stoffe zersetzt oder in andere Stoffe umgesetzt werden. Geht es um die Gewinnung von Wasserstoff, ist der .Was sagt die elektrochemische Spannungsreihe aus und wie kannst du aus ihr das Verhalten eines Redoxpaares in einer Reaktion bestimmen? Genau das zeigen wir dir in . An einer Pb – . Hier würde Wasserstoff aus elektrischer Energie mittels Elektrolyse gewonnen, und umgekehrt könnte aus Wasserstoff mit Hilfe von Brennstoffzellen auch wieder elektrische Energie .Wir erklären dir die Elektrolyse von Wasser mit den zugehörigen Reaktionen und ihren Gleichungen.
Redoxreihe • einfach erklärt: Tabelle und Beispiele · [mit Video]
Die Redoxpaare sind über einen Elektronenleiter (Kabel) und einen Ionenleiter (Separator) verbunden. Unter sehr hohen Temperaturen geht die Elektrolyse auch ohne vorherige .Die Grundlage der Elektrolyse ist ein mit dem Stromfluss verbundener Stofftransport im Elektrolyten.Wie ist der Aufbau und die Funktion einer Elektrolysezelle? Hier einfach erklärt! Beispiel: Elektrolyse von Zinkiodid berechnet (mit Formeln)Eine Definition. Fließt durch einen Elektrolyten ein Gleichstrom, so wirkt die in den Elektrolyten eintauchende Katode als Elektronendonator. Der Begriff Wasserstoffelektrode wird allgemein für Elektroden verwendet, an denen Wasserstoffgas H 2 entwickelt oder verbraucht wird. Diese kommt aus dem Gebiet der Elektrochemie.Lerne Schritt-für-Schritt anhand der Elektrolyse von Zinkiodid, wie diese funktionieren.
Sie sind dort nach ihrem sogenannten Redoxpotential geordnet.Solche Flüssigkeiten sind Elektrolyte. Hier reagiert Eisen (III)-oxid (Fe 2 O 3) mit Aluminium (Al) zu Eisen (Fe) und Aluminiumoxid (Al 2 O 3 ). Vor allem bei Metallen wie beispielsweise Zink (Zn) oder Kupfer (Cu) nennst du die Anordnung Redoxreihe.zur Stelle im Video springen.
Nernst Gleichung · Herleitung & Beispiele · [mit Video]
Ein Elektrolyseur ist ein Hightech-Gerät, in dem ein Stoff mithilfe von Strom in seine Bestandteile zerlegt wird. In diesem Artikel .Das Phänomen kann anhand des elektrochemischen Potenzials mit Hilfe einer Redoxreaktion erklärt werden. Bleiakkumulatoren gelten für eine Lebensdauer von einigen Jahren als zuverlässig und preisgünstig. So entsteht bei der Photosynthese von Pflanzen mithilfe der Elektrolyse, der für uns überlebensnotwendige . Das zu analysierende Stoffgemisch wird mit der ungefähr drei- bis vierfachen Menge an kristallinem Natriumcarbonat versetzt. Bleidioxid und der Elektrolyt aus verdünnter Schwefelsäure bestehen. Durchführung und Reaktion. Atom, Ionen, Reaktion. Für ein besseres Verständnis ist das Faraday Gesetz im Video noch anschaulicher mit Bild und Ton dargestellt.
Reaktionen und ihre Gleichungen. Unter dem Redoxpotential verstehst du eine Messgröße, die . Er besteht aus einer .Hier erfährst du, wie die ursprünglich zwei Faraday’schen Gesetze formuliert wurden und wie das Gesetz in der heutigen Zeit formuliert wird. Wir fassen zusammen: .Elektrolyse Galvanische Zelle einfach erklärt . Nach Zusatz von Wasser wird das Gemisch für .Bisher spielt die Elektrolyse keine wichtige Rolle in der Energietechnik. Wasserstoff ist ein facettenreicher Themenkomplex . In einem YouTube Video (siehe der Link unten und der Screenshot) wurde erklärt, dass sich in der Zinksulfatlösung, zweifach positive Zink-Ionen und negative Iodid-Ionen befinden.Mit einer Elektrolyse kannst du aus Ionen die elementaren Stoffe gewinnen.Nernst Gleichung einfach erklärt Nernst Gleichung Herleitung Nernst Gleichung Beispiel Nernst Gleichung einfach erklärt im Video zur Stelle im Video springen (00:19) Zuerst einmal sollte man klären, was die Nernst Gleichung (engl. JenerDerBleibt.Wasserstoffelektrode. Die Zersetzungsspannung wird . Die Elektrolyse von Wasser und das Galvanisieren sind zwei technische Anwendungen für die chemische Wirkung von Strom. Merke: Dort benutzt man die Nernst .deElektrolyse einfach erklärt – Helles Köpfchenhelles-koepfchen.Aufgabe: Aus der stark sauren Pb2+ – Lösung scheidet sich bei der Elektrolyse an einer Pb- Kathode kein Wasserstoff, sondern Blei ab. Das Gesamt- Reaktionsschema dieser Redoxreaktion lautet: 2 H 2 O ( l) Elektrolyse → 2 H 2 ( g) + O 2 ( g) Δ H 0 = + 571, 8 kJ (bei T = 298 K, p = 1,013 x 10^5 Pa) Wasser wird . Die gesamte Elektrolysereaktion lautet: 2 NaCl + 2 H 2 O → 2 NaOH + H 2 + Cl 2.Körperbehaarung als symbolisches Zeugnis der Selbstdarstellung. Die Kathode ist diejenige Elektrode, durch die Elektronen einem Raum bzw .Lexikon der Chemie Elektrolyse. Die beiden Bleiplatten überziehen sich mit einer weißen Schicht. Im Elektrolyten befinden sich geladene Teilchen, die durch Auflösung einer Säure, Base oder eines Salzes in einem Lösungsmittel – meist Wasser – freigesetzt werden. In der Redoxreihe findest du verschiedene Redox-Paare aufgelistet.Hier kannst du nun üben die Teilreaktionen für die Redoxreaktionen aufzustellen: Beispiel 1: Calcium reagiert mit Chlor in saurem Milieu zu Calciumchlorid.Elektrolyse einfach.Mithilfe der Elektrolyse von Wasser kann man Wasser in Sauerstoff und Wasserstoff trennen. Die Oxidation findet immer an der .Redoxreihe einfach erklärt.
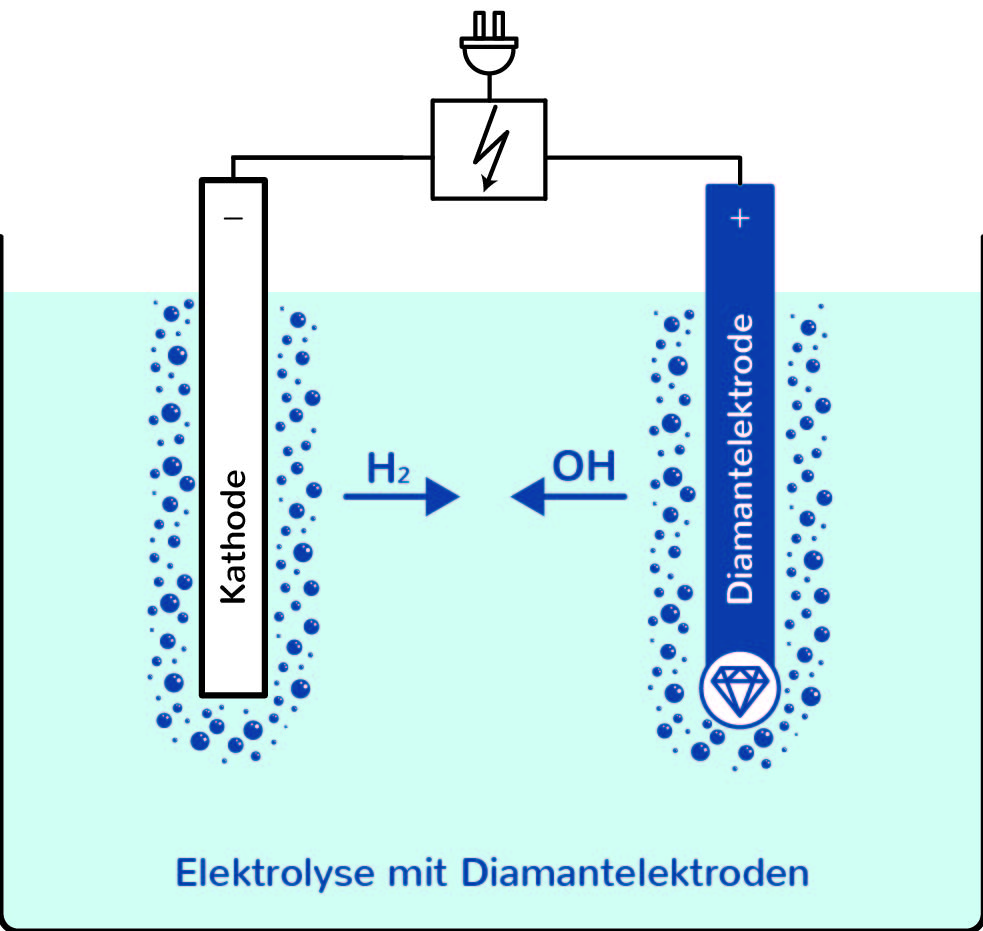
Die Elektrolyse verständlich erklärt!
Sie bilden eine verdünnte Natronlauge. Die Wasserstoffelektrode ist ein wichtiges Hilfsmittel für Messungen in der Elektrochemie und der Physikalischen Chemie: Sie ist eine der wichtigsten Referenzelektroden, das heißt, .Video ansehenMit den Aufgaben zum Video Elektrolyse – erzwungene Redoxreaktionen kannst du es wiederholen und üben.
![Elektrolyse · Prinzip, Wirkungsgrad, Beispiele · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/01/WP_Elektrolyse_2_ablauf-1-1024x576.jpg)
Ein Bleiakkumulator (kurz Bleiakku) ist ein Akkumulator, bei dem die Elektroden aus Blei bzw.
![Elektrolyse · Prinzip, Wirkungsgrad, Beispiele · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/01/WP_Elektrolyse-Anwendungsgebiete_3-1024x576.jpg)
Wasser wird oft technisch genutzt.
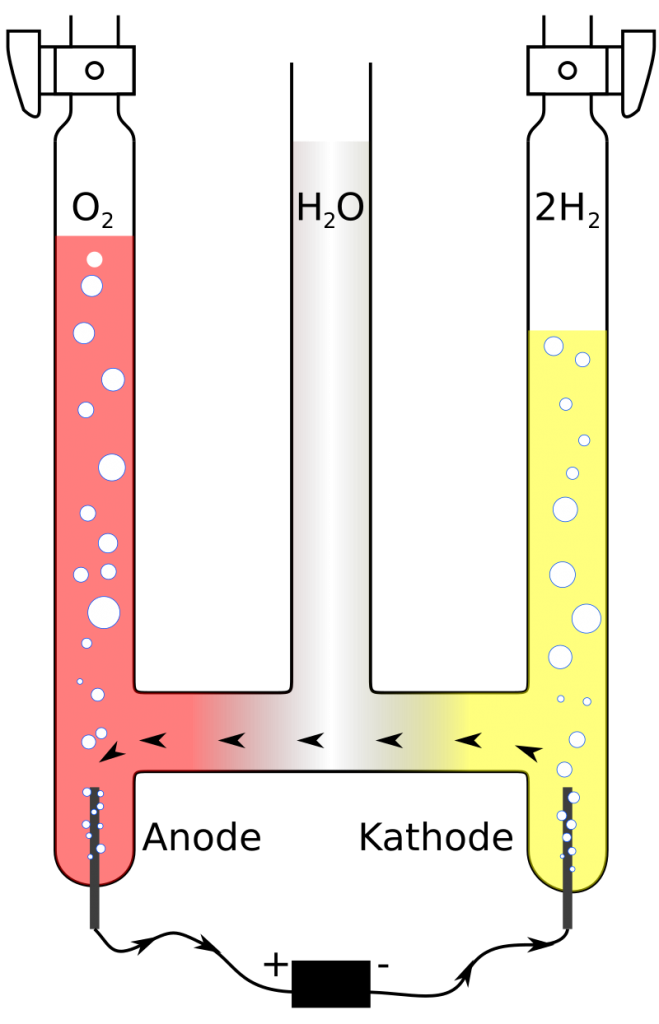
Elektrolyse von Wasser: Zusammenfassung
aus Zinkiodid (ZnI₂) elementares Zink und Iod gewinnen.Eine Elektrolyse ist die Umkehrung der in der galvanischen Zelle freiwillig ablaufenden Reaktionen. Die Anode der Elektrolysezelle wirkt als Elektronenakzeptor. Während also die Reaktionen in der galvanischen Zelle . Als Elektrolyse wird die chemische Zersetzung bestimmter Stoffe unter der Einwirkung von elektrischem Strom bezeichnet. Was passiert, wenn du die Spannung einer 4,5-Volt-Batterie in eine Kochsalz-Lösung leitest? Hier erklären wir dir das Prinzip der Elektrolyse, die du in einem Experiment zuhause selbst ausprobieren kannst.Einen Prozess, bei dem ein elektrischer Strom eine Redoxreaktion erzwingt, nennt man Elektrolyse.Zu den wichtigsten Merkmalen der PEM-Elektrolyse gehören eine kurze Reaktionszeit, eine ausreichende Teilleistungsfähigkeit oder Flexibilität und eine hohe Stromdichte. Elektrolyse, Elektrosynthese, eine durch elektrischen Strom erzwungene, chemische Umsetzung, die in einer Elektrolysezelle abläuft.Elektrolyse in Chemie | Schülerlexikon | Lernhelferlernhelfer.be/7FFNZrPkkogInhalt:00:0.Die Bedeutung der Elektrolyse.
![Elektrolyse · Prinzip, Wirkungsgrad, Beispiele · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/01/WP_Elektrolyse-Anwendungsgebiete_2-1-1024x576.jpg)
Eine einfache Elektrolysezelle besteht aus Anode (positiver Pol), an der die Oxidationsvorgänge stattfinden, Kathode (negativer Pol), an der sich die Reduktionsvorgänge abspielen . Die Elektrolyse ist ein Prozess, bei dem durch elektrischen Strom eine Redoxreaktion erzeugt wird. Durch Anlegen einer Zersetzungsspannung können die Vorgänge zwischen zwei Halbzellen eines galvanischen Elements umgekehrt werden. Inhaltsübersicht.
Faradaysche Gesetze · Elektrolyse, Gleichung · [mit Video]
Mit der Elektrolyse kann man unter anderem auch Wasserstoff herstellen. Sie wird beispielsweise zur Gewinnung von Metallen verwendet, oder zur .
Elektrolyse einfach
Sodaauszug
Herstellung: Man taucht zwei Bleiplatten in 20%-ige Schwefelsäure (H₂SO₄).Elektrolyse als erzwungene Redoxreaktion. Fe 2 O 3 + 2 Al → 2 Fe + Al 2 O 3. Dabei wird die elektrische Spannung (U) langsam erhöht und mit einem Strommessgerät die Stromstärke (I) gemessen. Dadurch wird elektrische Energie in chemische Energie . Außerdem erfährst du, was der Hofmannsche Zersetzungsapparat ist und .
Redoxreaktionen Übungen • Oxidationszahlen, Teilreaktionen

Weitere Beispiele sind die Gewinnung von Wasserstoff, . Wasser hat eine ganze Reihe von Eigenschaften, welche diese Flüssigkeit für Technik und Wissenschaft so interessant machen.Wenn Chemie eines deiner abiturrelevanten Fächer ist, wirst du auch die Redoxreaktion und Grundwissen zur Elektrochemie kennen und erklären können müssen.Hallo, ich brauche dringend Hilfe in Chemie zum Thema: „Elektrolyse“. :Nernst equation) überhaupt ist.Zurzeit werden PEM-Elektrolyse-Stacks mit einem geringen Automatisierungsgrad vornehmlich in Handarbeit und in kleinen Stückzahlen . Bei der technischen Gewinnung von Elementen spielt die Elektrolyse eine herausragende Rolle.3,7/5(190)
Die Elektrolyse
im Video zur Stelle im Video springen (00:14) Eine galvanische Zelle (auch galvanische Kette oder galvanisches Element) ist ein Aufbau, bei dem chemische in . Außerdem zeigen wir dir, wie du die Gesetzmäßigkeit anwenden kannst. Elektronen aufschreiben: Oxidation: Ca → Ca2+ + 2 e– Reduktion: Cl2 + 2 e– → 2 Cl–.Der Sodaauszug ist in der qualitativen analytischen Chemie eine Methode zur Abtrennung evtl.Elektrische Energie (Strom) wird in chemische Energie (Stoffe) umgewandelt.
![Elektrolyse von Wasser · einfach erklärt · [mit Video]](https://d3f6gjnauy613m.cloudfront.net/system/production/videos/001/643/af9131d54d2259aa5129d7f63f75afbbdf7e0db4/Elektrolyse_von_Wasser_Thumbnail.png?1583407209)
Die Elektrolyse ist die Umkehrung galvanischer Prozesse durch Verrichten elektrischer Arbeit.
Elektrolyse Pb2+ Erklärung
Das Wichtigste auf einen Blick.Stromstärke-Spannungs-Kurve bei Elektrolysen und Überspannung C3CL ⭳ : laborberufe.Somit ist die Elektrolyse für die Herstellung von Wasserstoff notwendig: Hierbei werden aus zwei Wassermolekülen (2H 2 O) je zwei Wasserstoffmoleküle (2H 2) und ein Sauerstoffmolekül (O 2) gewonnen. 1 Versuchsaufbau. Dabei wird elektrische Energie in chemische Energie umgewandelt. Dieser Vorgang ist in unserem Alltag von essentieller Bedeutung. In eine Kupfersulfatlösung wird eine mit dem Pluspol verbundene Kupferelektrode und eine mit dem Minuspol verbundene Kohleelektrode getaucht.Bei der Elektrolyse handelt es sich um einen erzwungenen Prozess, bei welchem die Prozesse des Galvanischen Elements durch das Anlegen einer Gleichspannung umgekehrt werden. Nach einiger Zeit des Stromdurchgangs durch den Elektrolyten scheidet sich an der Kohleelektrode bräunliches metallisches Kupfer ab. Oxidationszahlen: 0 0 +II -I Reaktionsgleichung: Ca + Cl 2 ⇢ CaCl 2.Galvanische Zellen und Elektrolyse-Zellen sind aus zwei Redoxpaaren, die räumlich voneinander getrennt sind, aufgebaut.de Eine Kupfer(II)-chloridlösung wird mit verschiedenen Elektrodenmaterialien elektrolysiert. Beschreibe den Aufbau einer Zinkbromid-Zelle.Bei dem Elektrolyse-Verfahren der alkalischen Elektrolyse komme ätzende Kalilauge zum Einsatz, erklärt Jan Simoneit von Energy Engineers. Diese Entdeckung von Johann Wilhelm Ritter von 1800 sollte man einfach mal gesehen . Modellvorstellung: So kann Wasser elektrolysiert werden, indem man zwei Platinelektroden in . Taucht man einen Zinkstab in die Kupfer(II)-salz-Lösung, werden die Zink-Atome unter Elektronenabgabe zu Zink 2+-Ionen oxidiert, die in Lösung gehen, während die Kupfer 2+-Ionen in der Lösung mit Hilfe der freigesetzten Elektronen . Die Oxidation und Reduktion laufen in den Zellen räumlich voneinander getrennt ab.
- Urlaub In Imst: Sehenswürdigkeiten Und Aktivitäten
- Access Form Timer Expression – MS Access: Format Function (with Dates)
- Battlefield 2042 Gold Edition – Battlefield 2042 vorbestellen: Editionen, Preise und Zusatzinhalte
- Cuantas Calorías Tiene Un Dátil
- Sanetta Kundenservice : Widerrufsrecht
- What Does Lamb Taste Like? It’S Not Bad At All!
- Spongebob Ending Credits _ The SpongeBob SquarePants Movie (2004) End Credits (PAL Pitch)
- Die Richtige Maus Für Jedes Endgerät
- Ichthraletten; Lösung Gegen Fettige Haut
- Plan Your Visit To The National Waterfront Museum
- Detailed Road Map Of Rancho Mirage
- Visage Triangle Inversé Femme : Comment Choisir
- Wie Lange Dauert Es Heutzutage Eigentlich Eine Anime Folge