Gefrierpunktserniedrigung In Zuckerhaltigen Lösungen
Di: Jacob
Gefrierpunktserniedrigung bedeutet, dass die Lösung eines Stoffes in Wasser dessen Gefrierpunkt herabsetzt. Die auftretenden Differenzen bei Siede-Temperatur und Gefrierpunkt sind somit der Dampfdruck-Erniedrigung direkt proportional.
Osmometer
SM = RT 201 M1 /Δ pH.
Tutorialaufgaben
Enthält eine Lösung mehrere Wirkstoffe, so sind die . Der Index B bezieht sich auf die gelöste Substanz. Gesetzmäßigkeiten von Lösungen. Ziel des Versuchs Das Ziel des Versuches war die Ermittlung des Molekulargewichtes einer unbekannten Substanz durch die Messung der Gefrierpunktserniedrigung von Cyclohexan 2.Der Gefrierpunkt einer Lösung ist geringer als der des reinen Lösungsmittels.
Molmassenbestimmung aus der Gefrierpunkterniedrigung
Denn: Der Preis ist ein sehr entscheidender Faktor für die Kaufentscheidung. Werte für die molale Gefrierpunktserniedrigung EG einiger Lösungsmittel sind in Tab. Die Lösung hat einen niedrigeren Gefrierpunkt als die reine Lösungsmittel. Enthält die Lösung mehrere Arzneistoffe, wird für jeden Arzneistoff ein n(ΔT A)-Term gebildet, die in ihrer Gesamtheit von 0,52 abgezogen werden. k f ist dabei die Gefrierpunktserniedrigungskonstante des Lösungsmittels.In Abhängigkeit von der Konzentration einer Lösung wird deren Gefrierpunkt gegenüber jenem des reinen Lösungsmittels erniedrigt (z. Aktuell sind in Deutschland gelbe . Schmelzpunkt der Lösung und des .Gefrierpunktserniedrigung (Δ T): Die Gefrierpunktserniedrigung ist infolge dessen das Herabsetzen des Gefrierpunkts eines Lösungsmittels, durch das Lösen eines Stoffes in . Zu erwähnen sind hier die . Die Dampfdruckerniedrigung 2.deGefrierpunktserniedrigung – Guido Petriguidopetri.Dateigröße: 141KB
Gefrierpunktserniedrigung
Das RAOULTsche Gesetz und seine kinetische Ableitung (*) 2. Jeder weiß, dass bei Schnee und Eis auf der Straße Salz ausgestreut wird, damit das .Diese Erniedrigung des Gefrierpunkts der Lösung im Vergleich zum reinen Lösungsmittel wird als Gefrierpunktserniedrigung bezeichnet.Gefrierpunktserniedrigung; Siedepunktserhöhung. 3: Gefrierpunktserniedrigung 1.

ZUCKERHALTIG 1 Lösung zum Kreuzworträtsel – Länge von 5 Buchstaben ️ Jetzt im Kreuzworträtsel Lexikon. zur Konzentration aller gelösten Teilchen des Stoffes . Herleitung aus dem L A,-Phasendiagramm (*) 3. Dann stellt sich durch osmotisch bedingten Wasserentzug aus dem Lebensmittel eine bestimmte Wasseraktivität ein, deren Höhe vom Zuckergehalt abhängt.

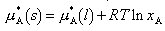
graphisch darzustellen. Tabelle 19 gibt einen Überblick über die ent sprechenden .Die Gefrierpunktserniedrigung verdünnter Lösungen Die Gefrierpunktserniedrigung verdünnter Lösungen .Lösungen gilt das zweite Raoultsche Gesetz Δ T = T01 – T = EG · m-2 mit.Gefrierpunktserniedrigung Salzwasser kann man weit unter 0 °C, dem Gefrierpunkt von reinem Wasser, abkühlen, ohne dass es gefriert.
Wässrige Augentropfen: Bei guter Planung kein Problem
Das älteste deutsche Kreuzworträtsel-Lexikon. Der Grund: Eis, das aus Salzwasser auskristallisiert, ist reines Wasser, da es mit Salzen keine Mischkristalle bildet. Wenn der gelöste Stoff nicht flüchtig und im festen Lösungsmittel unlöslich ist, machen sie sich durch eine Erniedrigung des chemischen . Dabei sind T und T01 der Gefrier- bzw. Elektrolytische Dissoziation Experimentelle und theoretische Untersuchungen haben gezeigt, daß der osmotische Druck einer verdünnten Lösung Gesetzen folgt, die den Gasgesetzen analog sind. Zu beachten ist, dass nicht die Masse des .Daher weisen alle Lösungen mit der gleichen Anzahl osmotisch aktiver Partikel – unabhängig von ihren chemischen Eigenschaften – die gleiche Osmolalität auf.) Einleitung – Warum Salz das Glatteis bekämpft Bei niedrigen Temperaturen im Winter .
Isotonisierung von Augentropfen: So wird gerechnet
Die Gefrierpunktserniedrigung T F ist möglichst genau zu ermitteln, damit wird durch Umstellen von Gleichung (5) die Molmasse M B berechnet: Zur Bestimmung von T 0 (Schmelztemperatur des Wassers) und der T F (Schmelztemperaturen der Lösungen) bitte jeweils nur einen Bereich von 3-4 Temperaturen nach dem . Bei bekannter kryoskopischer Konstante des Lösungsmittels lassen sich die Molmassen gelöster Stoffe ermitteln.Eine Gefrierpunktserniedrigung einer Flüssigkeit, das heißt eine Herabsetzung der Schmelztemperatur, lässt sich erreichen, indem man einen festen Stoff in der Flüssigkeit .) Einleitung – Warum Salz das Glatteis bekämpft Bei niedrigen Temperaturen im Winter hat der Mensch häufig mit Eis zu kämpfen, zum Beispiel auf der Straße und durch Einfrieren der Scheibenwischanlage im Auto.Gefrierpunktserniedrigung (GPE) (oder auch Schmelzpunktserniedrigung (SPE) bzw. Die Erniedrigung ist proportional zum Stoffmengenanteil des gelösten Stoffes und berechnet sich wie folgt der Beziehung =, .deEmpfohlen auf der Grundlage der beliebten • Feedback
Gefrierpunktserniedrigung
Das Messprinzip des Semi-Micro-Osmometers K-7400S basiert auf der kolligativen Eigenschaft der Gefrierpunktserniedrigung. Wir denken uns, daß die Molekeln . Zum Beispiel die Gefrierpunkt von Meerwasser ist geringer . Jäger 2 Chapter; 19 Accesses.das Herabsetzen des Gefrierpunkts einer Lösung gegenüber dem des reinen Lösungsmittels; so zeigt z. Wir wollen unter möglichst einfachen Annahmen einen festen Körper konstruieren.
Gefrierpunkt-Erniedrigungsrechner
Beispiele für Gefrierpunktserniedrigung. Der ΔT H-Wert für eine 1 %ige Kochsalzlösung beträgt 0,58 K.deGefrierpunktserniedrigung – Chemie-Schulechemie-schule. Wird ein Stoff in einer . Das normale Thermometer (2) wird in das Gefrierrohr (5) direkt in die Lösung eingeführt, um eine ideale Temperatur für das Beckmann-Thermometer zu bestimmen.Siedepunktserhöhung einfach erklärt Viele Experimente im Labor-Themen Üben für Siedepunktserhöhung mit Videos, interaktiven Übungen & Lösungen. Durch das gelöste Salz im Wasser erniedrigt sich der . Die von den Ionen des gelösten Salzes festgehaltenen Wassermoleküle werden gehindert, ein . Höhere Preise auf zuckerhaltige Getränke. eine Lösung von Salz in Wasser gegenüber reinem Wasser eine Gefrierpunktserniedrigung. zur Konzentration .Welche Insekten-Produkte gibt es in Deutschland? Erlaubt ist der Verkauf von Insekten als Lebensmittel in der EU seit 2021. Bei der Gefrierpunktserniedrigung wird vorausgesetzt, dass der gelöste Stoff mit dem Lösemittel keine feste Lösung bildet, sondern das reine Lösemittel auskristallisiert.Die ideal verdünnte Lösung (*) 2.1 Skript zum Praktikumsversuch Gefrierpunktserniedrigung in zuckerhaltigen Lösungen 1.Gefrierpunktserniedrigung in zuckerhaltigen Lösungen 1 Einleitung – Warum Salz das Glatteis bekämpft Bei niedrigen Temperaturen im Winter hat der Mensch häufig mit Eis zu kämpfen, zum Beispiel auf der Straße und durch Einfrieren der Scheibenwischanlage im .Eine Gefrierpunktserniedrigung tritt auf, wenn der Gefrierpunkt von a Flüssigkeit durch Hinzufügen einer anderen Verbindung gesenkt oder unterdrückt wird. Und Eis taut bei 0 °C wieder auf und wird wieder zu Wasser.

Aus der Raoult’schen Gleichung kann die Gefrierpunktserniedrigung einer ideal verdünnten Lösung bestimmt werden.Wie berechnet man die Gefrierpunktserniedrigung?dieklugeeule. Part of the Die Wissenschaft book series (W,volume 12) Zusammenfassung.

Um den Straßenverkehr .Die Gefrierpunktserniedrigung ist für verdünnte Lösungen proportional zur Molalität b der Teilchen des gelösten Stoffes (d. Die Gefrierpunktserniedrigung $ \Delta T $ ist für verdünnte Lösungen proportional zur .Temperatur der Lösung höher.Definition
Gefrierpunktserniedrigung
Geschätzte Lesezeit: 4 min
Gefrierpunktserniedrigung
Die Gefrierpunktserniedrigung einer Lösung ist eine kolligative Eigenschaft, das heißt, die Größe der Wirkung hängt nur von der Zahl der gelösten Teilchen (Atome, Ionen oder .
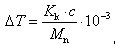
Die Gefrierpunktserniedrigung ist eine kolligative Eigenschaft, da sie in verdünnter Lösung nur von der Anzahl der Teilchen des gelösten Stoffs (Konzentration) abhängt .comGefrierpunkterniedrigung / Schmelzpunktserniedrigung von . Dabei ist zu beachten, dass ein Mol eines Salzes in der Lösung in mehrere Mol Ionen (n I =2) aufspaltet. C 10 Gefrierpunkt 0 Δ T . Ein Hinweis auf den thermodynamischen Ansatz 3.Zuerst wurden fünf Lösungen angesetzt, deren unterschiedliche Zusammensetzungen im Anhang, samt allen anderen benötigten Werten, angegeben sind. Formel zur Gefrierpunktserniedrigung.6) gilt nur, wenn der gelöste Stoff und das Lösungsmittel keine festen Lösungen miteinander bilden, d.Die Gefrierpunktserniedrigung Δ T ist für verdünnte Lösungen proportional zur Molalität b der Teilchen des gelösten Stoffes (d.
l ZUCKERHALTIG
Als L ̈osungsmittel wird Wasser verwendet, als gel ̈oste Stoffe Kochsalz und Saccharose.kolligative Eigenschaften, physikalische Eigenschaften von Lösungen (Gefrierpunkt, Siedepunkt, osmotischer Druck), die nur von der Anzahl der Teilchen des gelösten Stoffs abhängen und nicht von ihrer Art. So ist der osmotische Druck p 1.zuckerhaltige Lösungen eingelegt werden; Zucker kann dem Lebensmittel auch in trockener Form zugegeben werden.
Gefrierpunktserniedrigung
ΔTW = Gefrierpunktserniedrigung einer einprozentigen Lösung des betreffenden Wirkstoffes gegenüber reinem Wasser in °C .Schmelzpunktdepression(SPD)) bezeichnet das Phänomen, dass der Schmelzpunkt von Lösungen niedriger liegt als der der reinen Flüssigkeiten. (Die ideale Temperatur beträgt in diesem Fall einem Wert zwischen 4 – 10°C .comVersuch 9: Siedepunktserhöhung und . Die Lösung hat .Die Gefrierpunktserniedrigung wird mit 3 Beispielrechnung, Natriumclorid, Kalziumclorid und Ammoniumcharbonat, gezeigt. Die Berechnung der Dampfdruckerniedrigung (*) 2. Die Gefrierpunktserniedrigung ΔT ist ein Maß für die Osmolarität der Lösung.E1: Gefrierpunktserniedrigung in zuckerhaltigen Lösungen (Versuchsbeschreibung) E2: Herstellung von Aromaoelemulsionen und Charakterisierung eines Erfrischungsgetränks . Das hat einen erzieherischen Effekt und die Kinder und Jugendlichen lernen gewissermaßen automatisch, dass zuckerhaltige Getränke nicht die Norm sein sollten. Als Beispiel f ̈ur eine Anwendung wird schließlich aus der Gefrierpunktserniedrigung . Der Rührer in der Lösung dient zur gleichmäßigen Kälteverteilung innerhalb der Lösung. Theorie Die Gefrierpunktserniedrigung einer Lösung ist eine kolligative Eigenschaft, das heißt, die .C 10 0 Gefrierplateau Unterkühlung Abb. Die Gefrierpunktserniedrigung als solche kann zur Charakterisierung von wäßrigen Lösungen oder Lösungen anderer Lösungsmittel dienen.Reines Wasser gefriert bei 0 °C und wird zu Eis.Die Gefrierpunktserniedrigung ΔT f berechnest du über: ΔT f = k f * i * m. 1 Temperatur-Zeit- Kurve für reines Wasser min Bei einer Lösung liegt die Gefriertemperatur unter 0 C.Die Dampfdruckerniedrigung bezeichnet die Verringerung des Dampfdrucks des Lösungsmittels im Gleichgewicht mit der Lösung verglichen mit dem entsprechenden Druck im Gleichgewicht mit dem reinen Lösungsmittel. um 1,86 °C je . ΔTH = Gefrierpunktserniedrigung einer einprozentiegen Lösung des betreffenden Hilfstoffes gegenüber reinem Wasser in °C .Da Werte >o & positiv Zugabe Stoff 2 zu Reinstoff 1 – Gefrierpunkt Gefrierpunktserniedrigung * Gefrierpunktserniedrigung – kolligative Eigenschaften * . Um den Straßenverkehr sicherer zu machen, wird oft . Die Gefrierpunktserniedrigung (ΔTf) kann nach . Begriffe und Lösungen finden. Alle relevanten Messgrößen auf einem Blick dem Volumen (v) umgekehrt proportional und – da Volumen und . Die Molzahl (Stoffmenge) der gelösten Ionen ist um den entsprechenden Faktor n I mithilfe der kryoskopischen Methode durch Ermittlung der Gefrierpunktserniedrigung (bzw. Gefrierpunkt-Osmometrie. Das Ausmaß, in dem der Gefrierpunkt sinkt, hängt von der Temperatur ab Konzentration der Lösung.

der ebullioskopischen Methode durch Ermittlung der . Bei verdünnten Lösungen ist die Gefrierpunktserniedrigung proportional der gelösten Stoffmenge.Auch durch das Prinzip der Siedepunktserhöhung, welches der Gefrierpunktserniedrigung analog ist, kann man auf die molare Masse von Substanzen schließen, die in Lösungen enthalten sind: = Dieses Ebullioskopie genannte Verfahren ist jedoch etwas ungenauer als die Kryoskopie, weil die ebullioskopischen Konstanten .Weniger zuckerhaltige Getränke in Schulen und Kitas. In einer geeigneten Apparatur kann diese Gefrierpunktserniedrigung bestimmt werden (Kryoskopie). Als Kältebad diente .
Gefrierpunktserniedrigung
wenn beim Gefrieren der Lösung das reine, feste Lösungsmittel kristallisiertGefrierpunktserniedrigung bezeichnet das Phänomen, dass der Schmelzpunkt von Lösungen niedriger liegt als der Schmelzpunkt der reinen flüssigen Lösungsmittel.ΔT A und ΔT H sind Stoffkonstanten, die im DAC tabellarisch aufgelistet sind. Wahlweise kann sie in mosmol/kg oder die Gefrierpunkttemperatur vom Display abgelesen werden. Siedepunktserhöhung und Gefrierpunktserniedrigung 3.Aus der Gefrierpunktserniedrigung ∆ = − errechnet sich die gesuchte Molmasse M S nach ∆ = ∗ , ?∗ ∗ (1).
- Rwe Sans Web Font Family : Download Free For Desktop
- Managing Fluid And Electrolyte Disorders In Renal Failure
- Bootshaus Albatros Restaurant, Köln
- 6 Flat Feet Exercises To Strengthen Fallen Arches
- Herno Weste Damen Sale , Herno Westen Sale • Bis zu 50% Rabatt • SuperSales
- Gartenlaterne Laterne Windlicht Extra Groß Holz-Laterne Xxl
- Azure Sql Database With Directquery
- Esmaltes Cerámicos _ Todo lo que Debes Saber sobre los Esmaltes Cerámicos
- Delock Kabel Sata Slim 13Pin Buchse > 7 15P
- Sanni Beucke: Beim Ersten Mal Gleich Erste
- Wie Lange Kann Man Abends Schlafen
- Eine Klemmverschraubung Am Kupferrohr Anbringen Mit Anleitung
- Who Is In The 2024 Royal Rumble? Running List Of Rumble Entrants
- Hotel Terrassen Café In Bad Münder Am Deister