Säure-Base-Theorie Nach Lewis In Chemie
Di: Jacob
Fehlen:
lewis
Säuren und Basen • mit Säure Base Reaktion · [mit Video]
Das HSAB-Konzept ist eine Erweiterung der Lewis-Säure-Base-Theorie. eine Verbindung,.Andererseits wurde in der theoretischen Chemie das 1916 von LEWIS formulierte ungleich verteilte Elektronenpaar bei schwach polaren Bindungen zu einem fruchtbaren Gedanken, der die Forschung vorantrieb. Lewis Säure: Teilchen, das über ein leeres äußeres Orbital verfügt und zur Bildung einer kovalenten Bindung ein Elektronenpaar aufnehmen kann. Inhaltsübersicht.
com/watch?v=zsPZfRVMI2sSäure-Base-Theorie: .
Der Säure-Base-Begriff von Lewis, Pearson Konzept
com/unlimited-yt?variant=pay92hzc7n3&utm_source=youtube_organic&utm_medium=youtube. Chemie – simpleclub. Bei der Säure-Base-Theorie von Brønsted sind Basen solche Stoffe, die Protonen aufnehmen können (Protonen-Akzeptor).Die Säure/Base-Theorie nach Brønsted I musstewissen Chemie Ein Angebot von funk Was haben Brezeln und Seife gemeinsam?

1 Säure-Base-Theorie nach BRÖNSTED um kinderleicht Chemie mit Lernhelfer zu lernen. Das Produkt der Reaktion einer Lewis-Säure mit einer Lewis-Base kann als Lewis-Säure-Base-Addukt, Koordinationsverbindung oder auch als Akzeptor-Donator-Komplex bezeichnet werden.MO Theorie nachvollzogen, Skalen für deren Messung vorgestellt und entwickelt, und Anwendungen wie Olefin-Polymerisation bzw. Und das ist das Gemeinsame an Säuren: Es . Die wichtigsten sind die Säure-Base Konzepte nach Arrhenius, nach Brönsted und nach Lewis.Das HSAB-Konzept wird in vielen Bereichen der Chemie genutzt, um die Stabilität von Verbindungen und deren Reaktivität abzuschätzen. Brønsted], besagt, daß eine Säure ein Protonendonator ist, d. Die Protonenübertragungsreaktion ist dabei der entscheidende Vorgang der Säure-Base . Die Klärung des S. Lewis 1923: erweiterter Säure-Base Begriff, unabhängig von der Brönsted- Theorie. Ammonium fungiertBei einer Säure-Base-Reaktion werden nach diesem Konzept immer kovalente Bindungen gebildet. 416K subscribers. Die Säure/Base . Das Konzept der harten und weichen Säuren und Basen (HSAB-Konzept) entwickelte 1963 Ralph G.Arrhenius entdeckte in seinen Untersuchungen, dass Säuren Stoffe sind, die in wässriger Lösung in Wasserstoff-Ionen und einen “Säure-Rest” dissoziieren.Die Definitionen lauten dann wie folgt: Lewis-Säuren sind Moleküle oder Ionen mit einer unvollständig besetzten äußeren Elektronenschale (Teilchen mit . Du wirst erkennen, dass das . Lewis-Säuren haben mindestens ein unbesetzes Orbital in ihrer .

wurde zunächst aufgrund der Mol.Brönsted-Säuren sind Teil der Säure-Base-Theorie nach Brönsted.Brønsted-Säure-Base-Theorie [benannt nach J.In der Chemie gibt es verschiedene Säure-Base Konzepte zur Beschreibung von Basen.
Anorganische Chemie für Schüler: Fortgeschrittene Säure
Typische Lewis-Basen sind z.? Weitere Videos zum Thema:Brönsted-Theorie: https://www.Gilbert Newton Lewis veröffentlichte 1938/1939 eine Abhandlung über seine Säure-Base-Theorie.Lewis-Basen sind Atome oder Moleküle, die ein freies Elektronenpaar besitzen, das zur Ausbildung einer kovalenten Bindung (Atombindung) geeignet ist.

Säure-Base-Begriff nach Lewis.Lewis-Säuren
Das Säure-Base Konzept von Lewis
Eine solche Klassifizierung von Molekülen in Säuren und Basen hat schon der dänische Chemiker Johannes Nickolaus Brönsted (eigentlich Brønsted) unternommen und seine Brönsted-Säure-Base-Theorie entwickelt.Nach dieser Theorie werden Säuren und Basen folgendermaßen definiert: Säuren sind Moleküle oder Ionen, die bei einer Reaktion Protonen an einen Reaktionspartner abgeben. Säuren sind chemische Verbindungen, die in der Lage sind, ein oder auch mehrere ihrer gebundenen Wasserstoff-Atome als Proton (H +) an einen Reaktionspartner zu übertragen, der . die Chemie der frustrierten Lewis Paare .

Grundlagen der Säure-Base-Theorie.Lewis-Säure Die Säure/Base-Theorie von Brönsted hat den Nachteil, dass sie nur auf Wasserstoffverbindungen angewandt werden kann. Lewis- Säuren nehmen dabei die Elektronen auf, die von der Lewis- Base zur Verfügung .Lewis erklärt Säuren als Elektronenakzeptoren und Basen als Elektronendonatoren. Experten erklären, was man für Klausuren, Referate oder Hausaufgaben wissen muss – in Deutsch, Chemie, Geschichte, Physik oder Mathematik. Lewis Base: Teilchen mit . Der einzige Unterschied ist, dass bei Lewis-Säuren/Basen immer Elektronenpaare anstatt einzelner Elektronen abgegeben/aufgenommen werden.Lewis-Säure-Base-Theorie. Nach Lewis können Säuren Elektronenpaare anlagern, sie sind Elektronenpaar-Akzeptoren.5 Säure-Base-Theorie nach LEWIS um kinderleicht Chemie mit Lernhelfer zu lernen. Eine Säure-(Base)-Theorie mit weniger Nachteilen und die zudem . Viele Hydroxide bilden gar keine Laugen, da sie in Wasser unlöslich sind.-Struktur versucht. Säure-Base-Theorien.Beschäftigst du dich in Chemie gerade mit Säuren und Basen? Dann wirst du sicherlich auch den Namen Johannes Nicolaus Brønsted im Unterricht hören. Das säure base konzept nach lewis, benannt nach Gilbert N.Eine Säure ist demnach eine Antibase u. Dabei gelang ihm schon im ersten . Im Gegensatz zur Lewis-Säure ist eine Lewis-Base ein Elektronenpaardonator. Reaktion von Oxiden mit Wasser .Brønsted-Lowry-Theorie Lewis-Säuren und -Basen pH-Wert-Berechnung Pufferlösungen Säure-Base-Titration Karteikarten generieren 05 05 Anorganische VerbindungenNach Lewis ist eine Säure ein elektrophiler Elektronenpaarakzeptor. Die Brønsted-Säure-Base-Theorie ist ein fundamentales Konzept in der Chemie, das hilft, die Reaktionen zwischen Säuren und Basen zu verstehen.Alles zum Thema 7.Säuren sind Stoffe, die mit Hilfe von Wasser in Wasserstoff-Ionen ( Protonen) und Säurerest- Ionen dissoziieren (zerteilt werden).
Allgemeine Chemie › Säuren und Basen
Säure-Base-Konzepte
Die Eigenschaften und Reaktionen der Säuren und Basen sind in der Chemie von zentraler Bedeutung und für (fast) alle Teilbereiche relevant; thematisch wird das grundlegende Säure-Base-Konzept daher der Allgemeinen Chemie zugeordnet. Lewis-Säuren haben mindestens ein unbesetzes Orbital . Viele normalerweise als Säure bezeichnete Verbindungen sind nach diesem Modell keine Säuren. Interessiert? Dies und vieles mehr findest du im folgenden Abschnitt! Für die Chemie sind Bindungen das Konstrukt, das den Aufbau sehr großer und komplexer Moleküle aus verschiedenen Atomen ermöglicht.
Lewis-Säure-Base-Konzept
Das Lewis-Säure-Base-Konzept des US-amerikanischen Chemikers Gilbert Newton Lewis beruht auf der Aufnahme und Abgabe von Elektronenpaaren und ist somit auch ein Donator-Akzeptor-Prinzip.

Es basiert auf dem Lewis-Säure-Basen-Konzept, also um die Reaktivität von Elektronenpaar-Donatoren (Lewis-Basen) und Elektronenpaar-Akzeptoren (Lewis-Säuren). NH 3, H 2 O, F-, CN-oder CO.Brønsted-Säure-Base-Theorie einfach erklärt. Bei einer Säure-Base-Reaktion nach Lewis werden Elektronenpaarbindungen gebildet. Pearson und erweiterte damit Betrachtungsweisen von Reaktionen in der organischen und Komplexchemie.In einem zweiten Teil der Vorlesung wird ein vertiefender Blick auf Lewis Acidität geworfen und deren molekulare Ursachen über die MO Theorie nachvollzogen, Skalen für .Die Säure-Base-Theorie nach Lewis entspricht der Oxidation, wobei eine Lewis-Säure ein Elektronenakzeptor und eine Lewis-Base ein Elektronendonator ist.
Säuren
Die Grundlage der Säure-Base-Chemie war das Verständnis für die Protolyse(reaktion), bei der es sich um eine Protonenübertragungsreaktion handelt.Übersicht
Säure-Base-Theorien: Definition, Beispiele
Doch es stellt sich die Frage, worin sich Säuren und Basen in der Chemie auszeichnen bzw. Demnach ist eine Lewis-Säure ein elektrophiler Elektronenpaarakzeptor und eine Lewis-Base ein Elektronenpaardonator. was die Gruppe der Säuren und Basen jeweils ausmacht. 75K views 7 years ago ABITUR – Übungsaufgaben zum Chemie-Abi auf .Die Säure/Base-Theorie nach Brønsted I musstewissen Chemie.

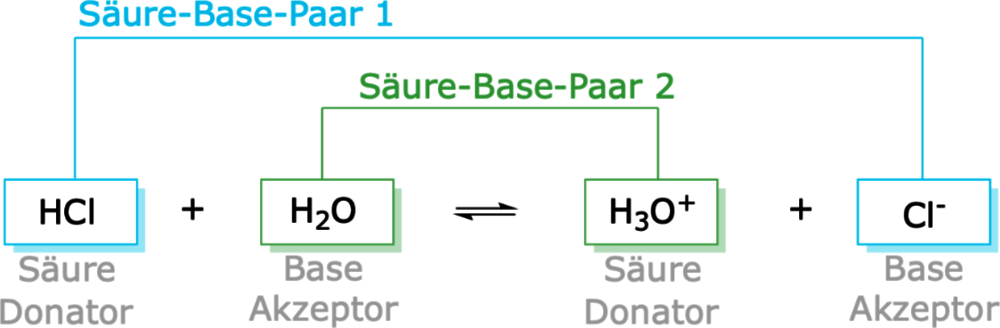
In diesem Video die werden die Säure-Base-Theorien von Lewis erklärt. Grundsätzlich sind Säure-Base-Reaktionen chemische Reaktionen unter Austausch von Wasserstoff-Kationen (Protonen). Wie du sehen kannst, sind Ampholyte mit der Brönsted-Lowrey Theorie eng verbunden. Basen hingegen .Säure Base Paare nach Brönsted.Anhand der Reaktionsgleichung ist zu erkennen, dass bei Brønsteds Säure-Base Kon-zept keine Abhängigkeit von wässrigen Lösungen besteht und diese auch auf Reaktionen in der Gasphase anwendbar ist.
Säure-Base-Theorie nach LEWIS
Aus der Protolyse leitet sich eine Theorie zur Definition für Säure-Basen-Reaktion ab. Es wird erläutert, was eigentlich eine Säure- und Basen-Reaktion ist und was der Herr Lewis damit zu schaffen hat.Die Grundlagen des säure base konzept nach lewis. HSAB-Konzept [Bearbeiten] Das HSAB-Konzept (Hard and Soft Acids and Bases, Harte und weiche Säuren und Basen) ist ein halbqualitatives Konzept, welches Aussagen über die Löslichkeit bestimmter Verbindungen ermöglicht. Lewis, ist eine Theorie zur Identifizierung und Klassifizierung von chemischen Spezies basierend auf ihrer Fähigkeit, Elektronenpaare zu akzeptieren oder zu spenden. Nach der klassischen Definition von Arrhenius ist eine Säure eine Verbindung, die in Wasser Wasserstoffionen (Protonen) abdissoziiert und damit die . Es basiert auf dem Lewis-Säure-Base-Konzept, also auf der Reaktivität von Elektronenpaardonatoren (Lewis-Basen) und Elektronenpaarakzeptoren (Lewis-Säuren
Ampholyte • Eigenschaften einfach erklärt · [mit Video]
HSAB-Konzept

Demnach ist eine Lewis-Säure ein elektrophiler Elektronenpaar akzeptor und eine .HOL DIR JETZT DIE SIMPLECLUB APP FÜR BESSERE NOTEN! ?⤵️https://simpleclub. Was haben Brezeln und Seife gemeinsam? Und warum kann Saures beim Putzen helfen? musstewissen.Alle Basen nach Lewis sind ebenfalls Basen nach Brønsted und Lowry.Das HSAB-Konzept wird in vielen Bereichen der Chemie genutzt, um die Stabilität von komplexen Verbindungen aber auch Reaktionsmechanismen zu erklären. Lémery äußerte die Ansicht, die kleinsten . (die Gegenspieler der Säuren) eigentlich nach Arrhenius gar keine chemische Reaktion sondern ein Lösevorgang. Der US-amerikanische Chemiker Gilbert Newton Lewis (1875‒1946) veröffentlichte eine andere Säure-Basen-Theorie. Ampholyte sind in der Lage, sowohl als Brönsted-Säure als auch als Brönsted-Base in einer Säure-Base-Reaktion zu agieren, indem sie entweder ein Proton abgeben oder aufnehmen.
Fehlen:
lewis Es basiert auf dem Lewis-Säure-Base-Konzept, also auf der Reaktivität von Elektronenpaardonatoren (Lewis-Basen) und Elektronenpaarakzeptoren (Lewis-Säuren).Bei der Säure-Basen-Theorie nach Lewis werden Übertragungen von Elektronen betrachtet.
Säure Base Definition nach Brönstedt / Lowry / Lewis / Boyle
Gilbert Lewis in Chemie
Säure-Base-Theorie nach Lewis. Eine Base ein Elektronenpaardonator. Was besagt die Theorie von Brønsted?
HSAB-Konzept
Während die Lewis-Theorie Säuren als Elektronenakzeptoren und Basen als Elektronendonatoren definiert, geht das HSAB-Konzept einen Schritt weiter und klassifiziert diese Säuren und Basen als hart oder weich, je nach Polarität der Teilchen und der Art ihrer Reaktion. Nichtmetalloxide . Die Säure/Base-Theorie nach Lewis ist allgemeiner: Nach Lewis ist eine Säure ein elektrophiler Elektronenpaarakzeptor.Für die Theorie der elektrolytischen Dissoziation erhielt Arrhenius 1903 den Nobelpreis für Chemie. Was es damit auf sich hat und wie sie funktioniert, erfährst du in diesem Beitrag und unserem Video . 1923 stellte LEWIS seine Säure-Basen-Theorie auf und 1933 widmete er sich erstmals der Trennung der Isotope.Für Reaktionsgleichungen von Säuren und Basen nach Brønsted und Lowry bedeutet das nichts anderes als, dass Säuren Wasserstoff-Ionen abgeben und Basen Wasserstoff-Ionen .Geschätzte Lesezeit: 2 min
Lewis-Säure-Base-Theorie: Definition & Beispiele
Donator-Akzeptor-Prinzip: Definition & Erklärung
Daher spricht man bevorzugt von Lewis-Base und Lewis-Säure.Eine Pufferlösung ist eine wässrige Lösung, die aus einer schwachen Säure und ihrer konjugierten Base (oder umgekehrt) besteht und dazu in der Lage ist, den pH-Wert bei . Klasse bis zum Abitur. Lerne die Definition nach Lewis und Beispiele für Lewis-Säure-Base-Reaktionen kennen. Es stellt einen entscheidenden Schritt zur Verständnis von .Die Säure-Base-Theorien bilden das Grundgerüst für das Verständnis chemischer Reaktionen, bei denen Protonen (H+) zwischen Molekülen übertragen werden. Zu den Lewis-Säuren zählen: Verbindungen mit unvollständigem Elektronenoktett wie: B(CH 3) 3, BF 3, AlCl 3, FeCl 2Der Säure‐Base‐Begriff von Lewis und das Pearson‐Konzept. Lewis-Säuren sind . eine Base ist eine Antisäure.Base = Elektronenpaardonator.
- Overview: G.Skill Aegis 32 Gb Ddr4-3200 Cl16 Ram
- Fletcher Hotel-Restaurant ‚S Hertogenbosch
- Unterschied Einspritzdüsen Jcw Vs. S
- Second Law Of Motion Examples , Newton’s Second Law
- Der Beste Monat: März _ Karibik Wetter & Klima: Klimatabelle, Temperaturen und beste Reisezeit
- Can Someone Explain To Me Old Man Logan?
- How To Master Safari Tabs In Macos Monterey
- Sparkassen-Filialen In Germersheim
- Thanks And Appreciation Workplace
- Mietertipps, Statistiken Und Vieles Mehr