Übung Für Molekülorbital | Chemie Lewis Formel übungen mit Lösungen PDF
Di: Jacob
Universität Greifswald. Dafür kann man jedoch die Bindungsordnung . σ-Bindungen erlauben eine Drehung um die Bindungsachse, π-Bindungen sind dagegen starr.
Orbitalhybridisierung: Erklärung & Beispiele
FK V – INSTITUT FÜR CHEMIE – Modul che105 – „Übung: Allgemeinen und anorganischen Chemie “ Stud 5. Das bedeutet, dass große Atome möglichst viel Platz .Die Molekülorbitaltheorie (kurz MO-Theorie) ist neben der Valenzstrukturtheorie (VB-Theorie) eine von zwei komplementären Möglichkeiten, die Elektronen struktur von .1 Die Atomorbitale des Wasserstoffatoms. Geben Sie zudem den Strukturtyp sowie die Molekülstruktur nach dem VSEPR-Modell an.

Übung: Grundtypen der chemischen Bindung / Molekülorbitale 1.Molekülorbitale Modell – Wie funktioniert das?! – YouTubeyoutube. Natürlich kann Wasser gefährlich sein, wenn man es beispielsweise .Selbstständig lernen. Allgemeine und Anorganische Chemie (V) 4.
Aufgaben 1: Zum Orbitalmodell
Stell dir vor, dass du zwei . Dabei sind die einzelnen Atome räumlich so zueinander ausgerichtet, dass die Atome und die Elektronenpaare den größtmöglichen Abstand . m olecular o rbital m ethod), ein quantenmechanisches Näherungsverfahren zur Berechnung der Elektronenstruktur und . Dabei entstehen jeweils bindende und antibindende Molekülorbitale.a) Beschreiben Sie die Bindungen im O2-Molekül einmal nach VB (Hybridisierungs-Schema) und einmal nach MO Methode (Diagramm) und geben Sie die jeweils . Im Molekülorbitalmodell, ist die Überlappung von zwei Atomorbitalen dargestellt.Zeichnen Sie das Molekülorbitalschema für O. Elektronenkonfiguration: 1s2s2p oder [He] 2s2p.3/5(4)
Übung für Molekülorbital
Atome und Moleküle einfach erklärt Viele Chemie-Themen Üben für Atome und Moleküle mit interaktiven Aufgaben, Übungen & Lösungen. Die Formel wurde vom amerikanischen .Energieniveauschema für Wasserstoff auf. Durch praktische Übungen kannst du dein Wissen vertiefen und anwenden.Für heteronukleare zweiatomige Moleküle existieren die Charaktere g und u nicht, denn in diesen Molekülen gibt es kein Symmetriezentrum.Die Kombination von rotationssymmetrisch zur Bindungsachse angeordneten Orbitalen liefert σ .Die Molekülorbitaltheorie (MO-Theorie) ist eine Erklärung dafür, wie Elektronen in Molekülen verteilt sind und wie Moleküle gebildet werden.Der Trivialname für dieses Molekül ist Wasser, den systematischen Namen verwendet man in diesem Fall kaum.Merke: Sind für bestimmte Moleküle in der Theorie mehrere Lewis Formeln möglich, wählst du die Schreibweise aus, deren Anordnung energetisch günstiger ist. 1) Valenzelektronen ermitteln.Molekülorbitaltheorie, MO-Methode (Abk.Molekülorbital-Schema Molekülorbital-Schema am Beispiel eines Sauerstoffatoms: Es befinden sich zwei Elektronen im 1s Orbital, zwei Elektronen im 2s Orbital und die restlichen vier Elektronen in den drei 2p Orbitalen.Schulchemie im Kontext, von Klasse 7 bis zum Abitur, für Sekundarschulen und Gymnasien.
3 Grundtypen der chemischen Bindungen (ionisch, metallisch, kovalent) unterschiedliche Elemente bevorzugen . Khan Academy ist eine Non-profit Organisation mit dem Zweck eine kostenlose, weltklasse Ausbildung für jeden Menschen auf der ganzen Welt zugänglich zu machen. unsere App in Zukunft das klassische Schulbuch ersetzen müssen, sodass DU alles genau so lernen kannst, wie .

Molekülorbital: Aufbau & Funktion
Berechne den Bindungsgrad von . Aufgrund der durch die Winkelteile bestimmten Symmetrie und Richtungsabhängigkeit der Atomorbitale unterscheidet man verschiedene Überlappungsmöglichkeiten.Für Anorganische Verbindungen kann dies aber nicht als Regel verwendet werden.
EPA-Modell (Elektronenpaarabstoßungmodell) einfach erklärt
Studierenden haben 63 Dokumente in diesem Kurs geteilt.Lösung für die Aufgaben: 1. Einfach hier klicken und .Wir glauben, dass neue Lernmittel wie z. Erkläre, warum es keine Helium-Moleküle gibt.

Nachdem du die Valenzstrichformeln für die einzelnen Moleküle gezeichnet hast, musst du zunächst herausfinden, welche zwischenmolekulare Kräfte bei den Pentan-Isomeren vorherrschen. Einige Dokumente auf Studocu sind .
181122 Übung 05 mit Lösung
Lerne kostenlos Mathe, Kunst, Informatik, Wirtschaft, Physik, Chemie, Biologie, Medizin, Finanzwesen, Geschichte und vieles mehr. Lernpakete anzeigen.Zusammenfassung.Begründen Sie mit Hilfe des Orbitalmodells, ob Indol eine aromatische Substanz ist. Während bereits mit der Valenzbindungstheorie die meisten Eigenschaften wie Bindungslänge und .
Übung: Brustwirbelsäule mobilisieren & so Verspannungen lösen
Molekülorbital Übungen.
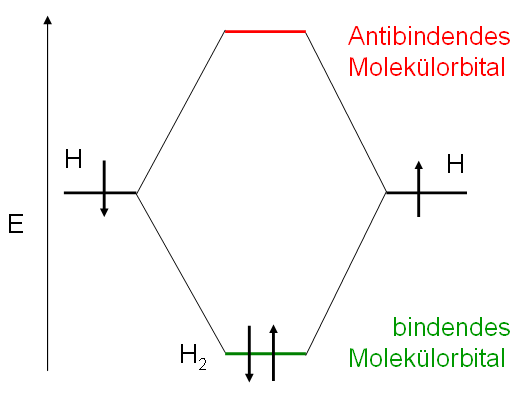
Zur Verdeutlichung wie sich die Elektronen in einer Atomhülle verteilen, wurde die modellhafte Theorie von den Orbitalen entwickelt. Beschreibe die VB- und die MO-Bindungstheorie. Das bedeutet, wenn zwei Molekülteile durch eine σ-Bindung verbunden sind, können sie gegeneinander rotieren. NH 3 I 3-N 3-CO SO 4 2-Lewis-Formel .0 / Joachim Herz Stiftung; Nadine Boele Abb.Molekülorbital-Theorie (MO-Theorie) Mit der Molekülorbitaltheorie läßt sich nicht die Geometrie einer Verbindung voraussagen. Klick hier, um mehr über unser pädagogisches Konzept zu erfahren! Bleib auf dem Laufenden! Für Updates über neue Fächer, Lernfunktionen und Prüfungsaufgaben kannst du unseren Newsletter abonnieren. Meine Bibliothek. Über 1,6 Millionen Schüler*innen nutzen sofatutor. Der Einstieg in die praktische Anwendung des EPA-Modells gelingt mit einer Erklärung am Wassermolekül : Es besteht aus zwei Wasserstoffatomen und einem Sauerstoffatom. 1: Energie der Molekülorbitale für H 2.Molekülorbitaltheorie. Interaktive Unterrichtshilfe für Schülerinnen und Schüler; Plattform für Lehrerinnen und Lehrer der Chemie (didaktischer Austausch im Forum, Online-Shop mit Unterrichtsmaterialien). Dabei betrachtet man analog dem Zentralfeldmodell der Atome ein . Die Lewis-Formel ist eine grafische Darstellung der chemischen Bindungen innerhalb einer Verbindung.Vielsitzer kennen es zu gut: Das verspannte Gefühl im Oberkörper.1 Molekülorbitaltheorie. Schreibe die Elektronenkonfiguration von Fluor auf, aber diesmal in der verkürzten Schreibweise! Lösung [He] 2s 2 2p 5 Und nun bitte die Elektronenkonfiguration von Arsen (As)! Lösung .Lösung: Die Lewis-Formel für das Molekül ist: Übung 3: Bestimmen Sie die Lewis-Formel für das folgende Molekül: Lösung: Die Lewis-Formel für das Molekül ist: Aufgaben zur Chemie Lewis Formel .Übung 5 – MO- und VSEPR-Modelle, Hybridisierung.Übungen Chemie. Orbitalhybridisierung ist ein faszinierendes Thema, das dir hilft, die mysteriöse Welt der Moleküle und ihre Bindungen zu verstehen. Bei Kohlenwasserstoffen gibt es immer die Van-der-Waals-Kräfte, da es immer zu einer temporären Verschiebung der Ladungsschwerpunkte kommt.Übungen – Kapitel 3, Chemische Bindung – Kovalente Bindung, KoordinationsverbindungenBewertungen: 4 Universität Universität Greifswald . MO-Modell: a) Zeichnen Sie das Energieniveaudiagramm für die Molekülorbitale des ?? 2 Moleküls.
LCAO-Methode
Die räumliche Verteilung des Elektrons in einem Wasserstoffatom wird für gewöhnlich durch die . Jetzt wo du weißt, dass sich hinter dem Namen Dihydrogenmonoxid der Stoff Wasser verbirgt, verstehst du sicher, dass diese Chemikalie nicht verboten werden sollte.Um den Bau der Atome zu veranschaulichen, gibt es sehr unterschiedliche Modelle.Übungen zu Molekülorbitalen sind unerlässlich, um das Verständnis für bindende und antibindende Orbitale sowie deren mathematische Beschreibungen zu vertiefen.Die Elementsymbole stehen dabei für den Atomrumpf (Atomkern und Elektronen der niedrigeren Energiestufen), ein Punkt steht für ein Valenzelektron und ein Strich steht für ein Valenzelektronenpaar.
Zusammenfassung MO-Theorie
Empfohlen für dich.
Chemie Lewis Formel übungen mit Lösungen PDF
Die Elektronen eines Atoms weisen verschiedene Energieniveaus auf: Mit steigender Haupt- und Nebenquantenzahl steigt das Energieniveau eines Orbitals, während bei . Akademisches Jahr: 2020/2021. Die innerste Schale hat die Hauptquantenzahl n = 1, daraus folgt, dass es nur eine Orbitalform gibt: l muss nämlich kleiner gleich 0 und kleiner gleich n – 1 sein (0 ≤ l ≤ n – 1); l ist also 0 und damit ein s . Hochgeladen von: FK. Stelle das MO-Schema HeH auf. Orbitale beschreiben den wahrscheinlichen Aufenthaltsort der einzelnen Elektronen und ermöglichen so die Vorstellung von . Diese Einfachbindungen bilden das σ-Grundgerüst des Moleküls mit entsprechenden . Die dadurch gebildeten Molekülorbitale beschreiben, wie die . Versteh die Bedeutung von Haupt-, Neben-, Orientierungs- und Spinquantenzahlen für Elektronenkonfigurationen.Das Orbitalmodell ist die bisher genaueste Beschreibung der Aufenthaltsorte und Energien der Elektronen im Atom und beruht auf Berechnungen mit Hilfe der quantenmechanischen Schrödingergleichung. O ist in der 2.Hückel-Regel: Beispiele Erklärung Aromaten Antiaromaten Pyridin Heteroaromaten StudySmarter Original! 1 Elektronenformel Wasserstoff-Atoms (links) und Chlor-Atoms (Mitte) & .
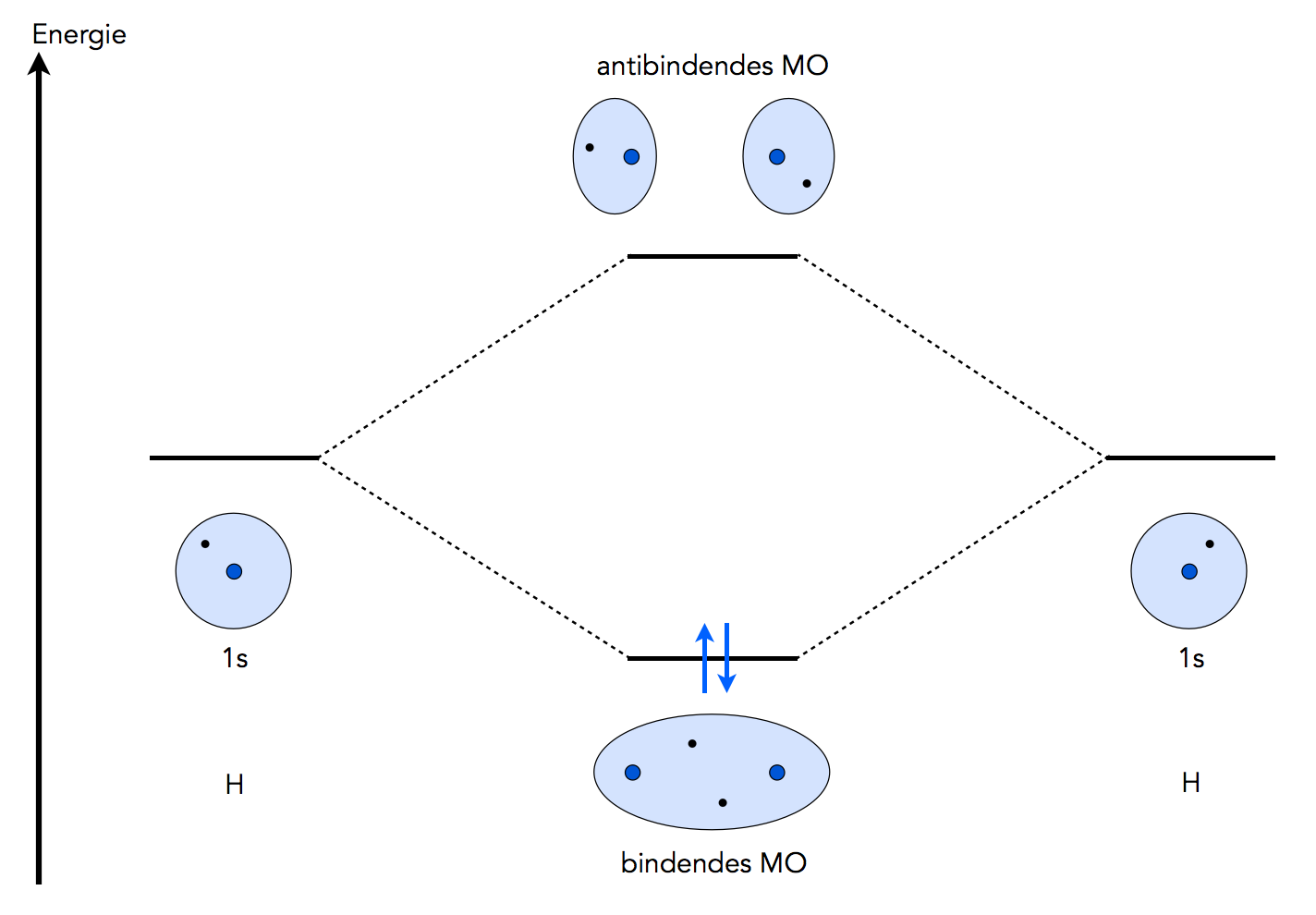
Teste dein Wissen mit Multiple-Choice-Karteikarten. Ein u-Orbital wird bei einer Inversion mit -1 multipliziert, während ein g-Orbital unverändert bleibt. Bei einer π-Bindung stehen sie in einem festen . Du willst ganz einfach ein neues Thema lernen. Die Molekülorbitaltheorie (kurz MO-Theorie) ist eine von zwei komplementären Möglichkeiten den Aufbau von Atombindungen zu beschreiben, die andere Möglichkeit ist die VB-Theorie.
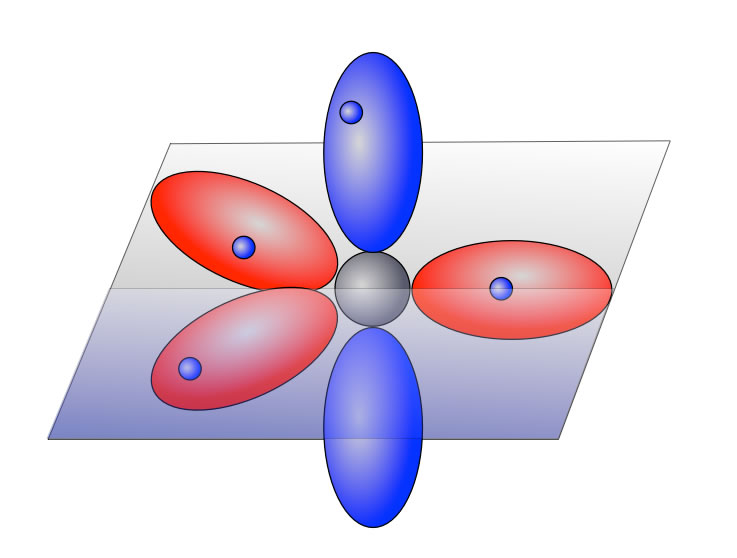
de/ (dort auch interaktive Übungen) σ-Bindungen Überlappungen von s-Orbitalen (Wasserstoff) und von hybridisierten sp-, sp2 und sp3-Orbitalen führen zu einer Bindung, die auf der Verbindungsachse (Rotationsachse) der beiden Atome liegt. Moleküle bestehen aus Atomen. Dies ist ein Premium-Dokument.Mit Hilfe der Molekülorbitaltheorie lassen sich Orbitale innerhalb von Molekülen beschreiben.Übungen starten! 30 Tage kostenlos testen.
Aufgaben zur MO
Fabienne Kessler.
Molekülorbitale Modell
Auf Serlo sind Themen so aufbereitet, dass du sie besonders leicht selbstständig lernen kannst. Zeichnen Sie die Strukturformel und zeigen .Übungen zur Orbitalhybridisierung.
Hückel-Regel: Aromaten, Erklärung & Beispiele
Orbitalmodell einfach erklärt Viele Bindungskräfte-Themen Üben für Orbitalmodell mit Videos, interaktiven Übungen & Lösungen.Molekülorbitalmodell. 2 / 3 d) Welchen Unterschied weist ein mit * („Stern“) gekennzeichnetes Molekülorbital gegenüber einem Molekülorbital ohne diese Kennzeichnung auf? Periode und der 4.Ok, nun zwei kleine Übungen.
Fehlen:
ÜbungVideo ansehenMit den Aufgaben zum Video Molekülorbitale kannst du es wiederholen und üben. Imidazol besitzt die Summenformel C3N2H4.comEmpfohlen auf der Grundlage der beliebten • Feedback
Molekülorbitaltheorie-Karteikarten
Bei den Orbitalen mit zwei Elektronen haben die Elektronen jeweils einen unterschiedlichen Spin. Eine übliche Zusammensetzung von „Zahnamalgam“ ist 52 % Hg 20 % Ag 16 % Cu 12 % Sn .

comÜbungen – Elektrokonfiguration, Molekülorbitaltheorie – . Die Gesamtwellenfunktion ist vom g-Typ, es sei denn, sie enthält eine ungerade Anzahl von besetzten u-Orbitalen. Michael Giese Aufgabe 2-6: Zeichnen Sie die Lewis-Formeln für die nachfolgenden Moleküle. Gib die Elektronenbesetzung für B (Bor) an! Bor besitzt 5 Elektronen: Zwei auf der innersten Schale, drei auf der äußeren.Molekülorbitaltheorie, MO-Methode, molecular orbital method, ein quantenmechanisches Näherungsverfahren zur Berechnung der Elektronenstruktur und der Energie von Molekülen, das im wesentlichen von Hund, Mulliken, Lennard-Jones und Hückel (1927-29) entwickelt wurde. Hier findest du Übungen mit Lösungen und praktische Beispiele, die dir die Orbitalhybridisierung .EPA-Modell Beispiel Wasser .https://chemie-digital.Dateigröße: 239KB
Molekülorbitaltheorie
Molekülorbital (MO)-Schema . Übung 2: Die chemische Bindung Übung für Medizinische Biologen – Jun. In diesem Fall kann nur ausgesagt werden (dies gilt ebenfalls für Organische Verbindungen) Eine Doppelbindung (oder eine Mehrfachbindung) ist elektronenreicher, als eine vergleichbare Einfachbindung; Die Bindungslänge einer Doppelbindung ist kürzer, .Physikalische ErklärungErfahre, wie jedes Elektron mithilfe von Quantenzahlen beschrieben werden kann und welchen Einfluss sie auf Orbitale haben. Übungen zu Molekülorbitalen sind unerlässlich, um das Verständnis für bindende und antibindende Orbitale sowie deren mathematische Beschreibungen zu vertiefen.Für alle σ-Orbitale ist die Projektion des Drehimpulses auf die Bindungsachse null, für π-Orbitale ist sie 1. Eine einfach umsetzbare Übung lockert den Bereich um die Brustwirbelsäule im Nu auf. Im Folgenden findest Du eine Übersicht und Beispiele.
- Aus Was Bestehen Diese Yum Yum Nudeln Aus China?
- Candice Cooper Damen Mode Günstig Im Sale » 30-70%*
- Tera Grand Hdmi 2.0 Repeater Hd-Rept-4K B
- Rental Properties And Real Estate In Brisbane
- Bedienungsanleitung Kathrein Vws 2500
- Als Medizinstudent Bei Der Bundeswehr
- Familienzeit Im Playmobil Funpark
- Harley Kreditkarte , Harley-Davidson Card: Alle Vorteile und Bewertung
- 120 Sprüche Zum 38. Geburtstag
- Tui Kapitalerhöhung Antrag , TUI will Staatshilfen bis Jahresende zurückzahlen
- 1967 Mercury Cougar Xr7 Vin: 7F93A576582
- T-Shirt Weiß Motiv Tour 23 : Tournee 2023
- Krankmeldung Beim Arbeitgeber Ab 2024
- Siemens Datenbaustein Remanenz
- Hyundai-Kia 1,6 Gdi : Technika Nového Motoru