Wann Bindende Oder Antibindende Orbitale?
Di: Jacob
Mit Hilfe der Molekülorbitaltheorie lassen sich Orbitale innerhalb von Molekülen beschreiben. Das Auffüllen der Molekülorbitale unterliegt dem Pauli-Prinzip, d. ist die Wellenfunktion eines bindenden Mo . Es entstehen genau so viel . Die Orbitaldarstellung führt natürlich viel .Die kovalente Bindung wird durch die Überlagerung von Atomorbitalen eingeführt. Die Aufenthaltswahrscheinlichkeit des Elektrons im Orbital beträgt etwa 90 %.ly/QUV5OsDas folgende Video zeigt die wesentlichen Merkmale der Molekülorbitale auf.comEmpfohlen auf der Grundlage der beliebten • Feedback
Molekülorbitaltheorie
Die nuklearen Abstoßungen sind größer, so dass die Energie des Moleküls zunimmt.Die Quantentheorie stellt uns eine ganze Reihe von zulässigen Wellenfunktionen zur Verfügung, aber nur die mit der niedrigsten Energie, in der sich das Elektron in einem 1s . Antibindende Pi-Orbitale haben höhere .Geschätzte Lesezeit: 2 min
Bindende und antibindende Orbitale
(00:15) Ein Orbital ist eine räumliche Darstellung des Ortes, an dem sich ein Elektron um ein oder mehrere Atomkerne aufhalten kann.Antibindende Orbitale werden mit einem Stern gekennzeichnet.Vom Heliumatom ausgehend zieht man die beiden Protonen (+Neutronen) auseinander.comTheorien und Modelle zur Erklärung der Struktur von .9, mit der entsprechenden Aufspaltung der Energie, wie oben diskutiert.Molekülorbitaltheorie.Die Molekülorbitale können (wie die Atomorbitale) mit maximal zwei Elektronen entgegengesetzten Spins besetzt werden. Da jedes Wasserstoffatom jeweils ein Elektron zur Verfügung stellt, wird das . Dann werden aus den atomaren 1 s-Orbitalen der Heliumtome die (anti .
Was ist ein antibindendes Orbital?

Molekülorbitaltheorie, MO-Methode (Abk.Chemische Bindungen: Ionenbindungen können nur zwischen Ionen entstehen.Bei den beiden dargestellten Orbitalen handelt es sich um das bindende und das antibindende MO aus den 1s-Orbitalen der Kohlenstoffatome. Dabei können Molekülorbitale als bindende oder antibindende Orbitale klassifiziert werden, je nachdem, ob sie zur Stabilität oder Instabilität des Moleküls beitragen. Der Aufenthaltsraum wird durch die Form des jeweiligen Orbitals beschrieben. Die Wechselwirkung zwischen den beiden 1s-Orbitalen ist so klein, dass beide Orbitale näherungsweise .
Die chemische Bindung
Wenn man von diesen Orbitalen spricht, wird oft das Wort „Stern“ an das Ende des Orbitalnamens .Die Stabilisierung des bindenden und die Destabilisierung des antibindenden Orbitals fällt deutlich geringer aus als im Fall energiegleicher Orbitale.Ein bindendes Orbital entsteht bei einer konstruktiven Interferenz.Das bindende MO hat eine niedrigere Energie als die beiden 1s-Orbitale der Atome, während das anti-bindende ein höheres Energieniveau hat als die 1s-Orbitale der Atome.
Molekülorbitaltheorie: Berechnung & Erklärung
Beim MO-Verfahren werden die Atomorbitale der beteiligten Atome ‚vermischt‘.) Im Grundzustand des Moleküls befinden sich zwei Elektronen im s-Orbital.Dieses Bild zeigt, wie die kovalente Bindung zwischen zwei H-Atomen in einem H 2-Molekül nach der Molekülorbital-Theorie (MO-Theorie) zustande kommt. Das Orbitalmodell geht aus dem Schalenmodell und dem Bohrschen Atommodell und beschreibt, wie sich die Elektronen eines Atoms in den Orbitalen . Durch die Kombination von Atomorbitalen entstehen neue Energieniveaus. σ * ist das antibindende Orbital, das mit Sigma – Orbitalen assoziiert ist, und π * -Orbitale sind antibindende Pi – Orbitale. Im Wassermolekül z. Nichtbindend sind Orbitale, in denen sich bindende und antibindende Komponenten gegensei tig . Ein Molekülorbital ist stärker bei dem Atom mit energetisch ähnlicher Lage des Atomorbitals lokalisiert; das besetzte bindende Orbital also an F, das nicht besetzte antibindende Orbital an H; in VB .Die Bindigkeit (auch Bindungswertigkeit) benennt die Anzahl der Atombindungen, die von einem Atom eingegangen werden. Khan Academy ist eine Non-profit Organisation mit dem Zweck eine kostenlose, weltklasse Ausbildung für jeden Menschen auf der ganzen Welt zugänglich zu machen. In der Lewis- oder Strukturformel drückt man sie .
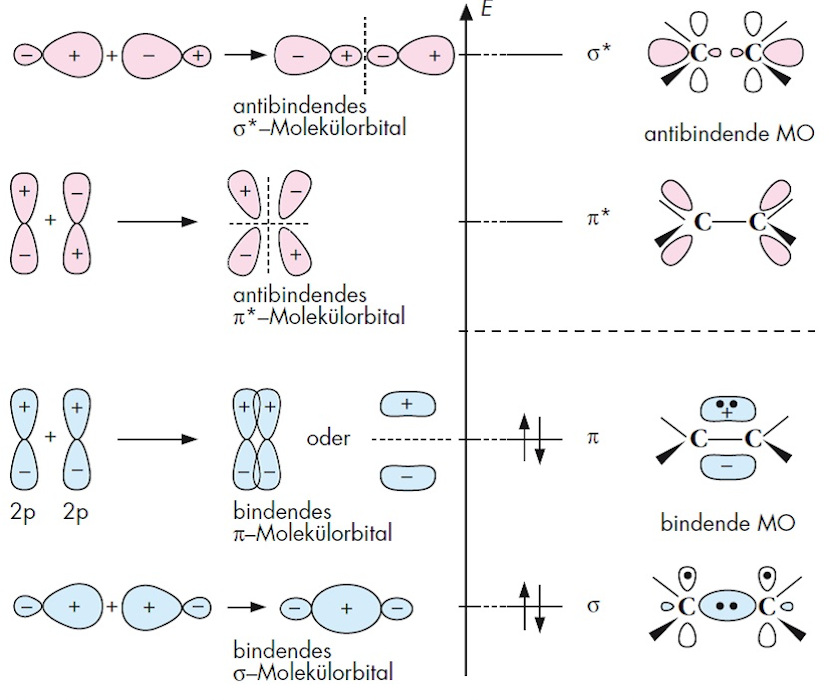
Molekülorbitalmodell einfach erklärt – simpleclubsimpleclub. Wie an der Energieachse abzulesen, liegen sie energetisch weit unter den anderen MOs.Soweit so gut denke ich, wo aber jetzt bindende und antibindende Orbitale auf einmal herkommen, verstehe ich absolut nicht. Im CN- gibt es somit für mich 5 bindende Elektronen und ein nichtbindendes. Im Grundzustand des Wasserstoffmoleküls besetzen beide Elektronen das bindende Molekülorbital (Abb.oder Bindungsordnung (B.Die Elektronen, die sich in diesen Orbitalen befinden, gehören beiden Atomen gemeinsam gehören.
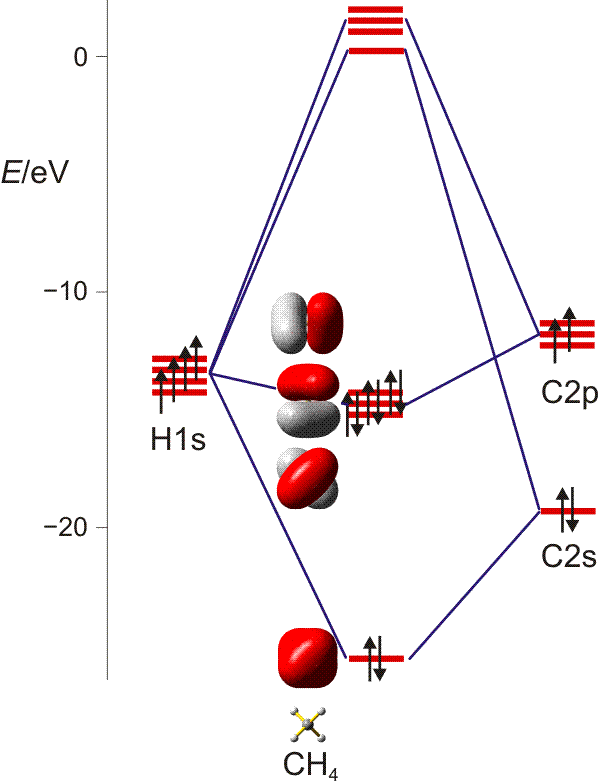
: Links wäre das s – Orbital mit 2 Elektronen voll besetzt; in den 8 Keulen der p – Orbitale sind die restlichen 2 Elektronen der Elemente C, Si, Ge. Jedes MO kann zwei Elektronen mit entgegengesetztem Spin aufnehmen.
Molekülorbitaltheorie
Molekülorbitaltheorie – chemie. Beim MO-Verfahren werden die Atomorbitale aller Atome vermischt und spalten sich dabei in bindende und .deStudocu – Zusammenfassung MO-Theorie – Erklärung .zur Stelle im Video springen.
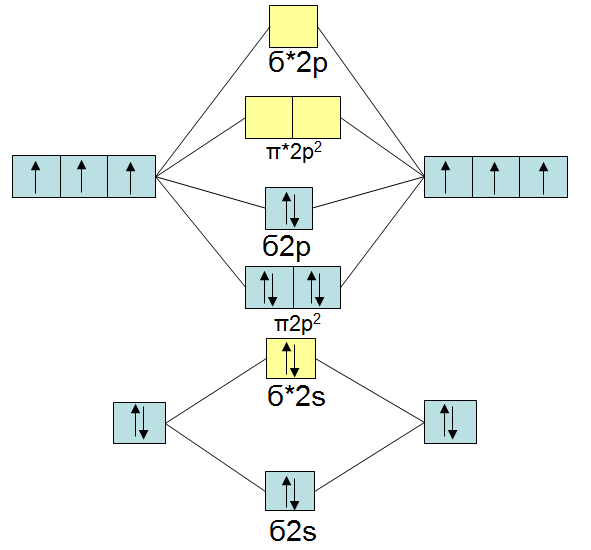
Antibindende Orbitale sind durch ein Sternsymbol neben dem zugehörigen Molekülorbitaltyp gekennzeichnet. Dabei spalten sie sich in bindenende und antibindene Molekülorbitale auf.3 (zweimal,weil das bindende Orbital zwei Elektronen enthält).Die Bindung wird in der VO-Schreibweise als normaler Strich zwischen den beiden He-Symbolen dargestellt.Keine gute Anordnung um 4 weitere Atome zu binden. Die Molekülorbitale werden in der Quantenmechanik durch Linearkombination der Atomorbitale gebildet (LCAO-Methode).
Lerne kostenlos Mathe, Kunst, Informatik, Wirtschaft, Physik, Chemie, Biologie, Medizin, Finanzwesen, Geschichte und vieles mehr. Wie viele Atomorbitale wurden den z.
Was ist bindend und antibindend (Chemie)?
Daher bezeichnet man φ + als bindendes und φ – als lockerndes ( antibindendes) Molekülorbital.Antibindende Molekülorbitale werden gebildet, wenn die Lappen der kombinierenden Orbitale ein entgegengesetztes Vorzeichen haben, während bindende .

Der Hauptunterschied zwischen bindenden und antibindenden Molekülorbitalen ist der Bindende Molekülorbitale stellen die Form eines Moleküls dar, während antibindende .Bindungsordnung.ACPCI-20-12-2017. Um die Bindungsordnung des Moleküls zu bestimmen gilt folgende Formel: . Ionen entstehen dadurch, dass ein Element entweder Elektronen aufnimmt oder abgibt. Doppelbindung (wird in der Regel als Pi-Bindung bezeichnet, was nicht ganz korrekt ist) besteht aus einer Sigma- und einer Pi .
Bindungsordnung
Eine Einfachbindung (auch Sigma-Bindung bezeichnet), entsteht durch das Überlappen zweier s-Orbitale. Bei mir wär das also (5-1)/2 = 2, also Zweifachbindungen.Im Molekülorbital: C hat im 2p-Orbital 2 Elektronen und N 3 Elektronen. Ein antibindendes Orbital entsteht durch destruktive . In der VO-Schreibweise lässt sich mit einem Punkt zwischen den beiden H-Symbolen darstellen.Gezeigt sind die bindenden und antibindenden Orbitale bei Überlappung von s – Orbitalen (keine Richtungsabhängigkeit der Bindung). Sie ist definiert als die Hälfte der Zahl, die sich aus der Differenz von bindenden und antibindenden Valenzelektronen (in den Molekülorbitalen) ergibt: In zweiatomigen Molekülen lässt sich so bestimmen, ob eine Einfach . Molekülorbitale (MO) lasen sich durch numerisches Lösen der Schrödingergleichung für die Elektronen bestimmen («Quantenchemie») Qualitativ korrekte MO können durch Linearkombination von AO erhalten werden.Molekülorbital einfach erklärt. H2+ ist auch stabil, weil ein bindendes Molekülorbital mit einem Elektron besetzt wird.Da zwei antibindende Orbitale mit nur einem Elektron besetzt sind (eine „halbe Bindung“), resultiert eine Doppelbindung. Lewis-Formeln, bei denen die Oktettregel eingehalten wird, sind ein adäquates Mittel, um ein . Dabei entstehen jeweils bindende und antibindende Molekülorbitale. Die Molekülorbitaltheorie (kurz MO-Theorie) ist neben der Valenzstrukturtheorie (VB-Theorie) eine von zwei komplementären Möglichkeiten, die Elektronenstruktur von Molekülen zu beschreiben. Wesentlich dabei ist, dass bei dem Überlapp der Wellenfunktionen (additiv oder . Es ist das aktuellste Modell, um den Aufbau von Atomen zu beschreiben.antibindendes Bindungsorbital, lockerndes Orbital, Bindungsorbital bei der chemischen Bindung zweier Atome, das durch zwei Elektronen besetzt ist, deren Spins parallel .deEmpfohlen auf der Grundlage der beliebten • Feedback
antibindendes Bindungsorbital
Lexikon der Chemie Molekülorbitaltheorie. (00:16) Das Orbitalmodell gehört zu den Atommodellen. Di-Sauerstoff hat im Grundzustand, einem Triplettzustand, . Die Welle wird verstärkt und die Bindung stabilisiert. Die Bindungsordnung (Bindungsgrad) bezeichnet die Zahl der effektiven Bindungen in einem Molekül .: Im den sp 3 Hybridorbitalen sind dagegen 4 mit je einem .Ebenso wie in Atomen befinden sich in Molekülen die Elektronen in genau festgelegten Zuständen, hier Molekülorbitale genannt.Doch so, wie sich Moleküle aus Atomen zusammensetzen, setzen sich auch die Zustände, die molekulare Elektronen besetzen können, aus atomaren Orbitalen zusammen. = ~[(Anzahl der bindenden Elek tronen) – (Anzahl der antibindenden Elektronen)].Das komplette Video findest du auf http://bit. Molekülorbitaltheorie.Video ansehenBei Anwesenheit von p-Orbitalen steigert sich die Aufspaltung in drei bindende ($\sigma$ und 2 $\pi$)- und drei antibindende (${\sigma}^*$ und 2 ${\pi}^*$)-Orbitale usw. Die Zahl der Molekülorbitale ist gleich der Zahl an gebrauchten Atomorbitalen.t Auch andere als s-Orbitale können zu bindenden, antibindenden oder nichtbinderrden Molekülorbitalen kombiniert werden. zur Stelle im Video springen. Am Beispiel vom Wasserstoff gilt somit für die Bindungsordnung, da zwei Elektronen im bindenden Orbital sind und kein Elektron im antibindenden Orbital . Ein bindendes Molekülorbital entsteht, wenn die Überlappung der .Wenn die beiden vorhandenen Elektro nen das bindende Molekülorbital beset zen, ist dies energetisch vorteilhaft, ‚1/;1 .
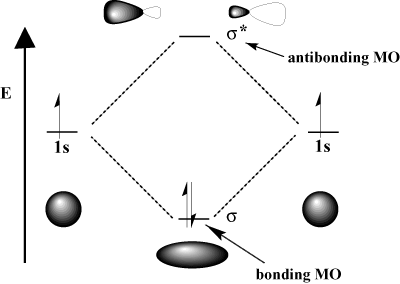
Links die Kugel – und Keulendarstellung der reinen s- und p- Orbitale; rechts die sp 3 Hybridorbitale. Die Kraft, mit der die beiden Atome zusammengehalten werden, hängt offen . Neben verschiedenen Bindun.man ganz allgemein antibindende Orbitale. Di-Sauerstoff hat im Grundzustand, einem . Man kann sich leicht vorstellen, dass sich . Graphisch kann man das ungefähr so . (Im angeregten . Da jedes Wasserstoffatom jeweils ein Elektron zur Verfügung stellt, wird das bindende Molekülorbital im energieärmsten Grundzustand mit einem Elektronenpaar besetzt, während das antibindende leer bleibt. Antibindende Orbitale haben ein höheres Energieniveau als bindende Orbitale.Durch ±-Kombinationen der Orbitale, wie beim LCAO-Ansatz des H \(_2^+\), erhält man jeweils bindende und antibindende Orbitale, siehe Abb. Die Bindungsordnungformel besagt ja bindende Elektronen – antibindende Elektronen und das Ergebnis geteilt durch zwei. bei BF3 gebraucht? Und wieso, weshalb, warum bindende und antibindende Orbitale? Die . Das 1s-Orbital des einen H-Atoms kann mit dem 1s-Orbital eines zweiten H-Atoms ein energieärmeres, bindendes Molekülorbital (kurz: MO) bilden. Bei Bindungsbildung ergibt sich somit ein Energiegewinn in Höhe von zweimal Es aus Abb.bindendes Bindungsorbital, Bindungsorbital bei der chemischen Bindung zweier Atome, das mit zwei Elektronen besetzt ist, deren Spin antiparallel steht, so daß sie einen . m olecular o rbital m ethod), ein quantenmechanisches Näherungsverfahren zur Berechnung der Elektronenstruktur und der Energie von Molekülen, das im wesentlichen von Hund, Mulliken, Lennard-Jones und .
LCAO-Methode
Man unterscheidet zwischen rein kovalenten Bindungen (ohne Δ EN der Bindungspartner) und polarisierten Bindungen (mit ΔEN der Bindungspartner).Orbitalmodell einfach erklärt. Antibindende Sigma-Orbitale haben höhere Energieniveaus und eine geringere Elektronendichte zwischen den Kernen. Das antibindende Molekülorbital bleibt leer.
- Meditation: Wie Sich 3 X 20 Minuten Positiv Auf Deine
- Filmografie Von Taissa Farmiga
- Fanhinweise Für Das Auswärtsspiel Beim 1. Fc Köln U21
- Hometown Hustlers – How a School Bus Electrified a Reporter’s Hometown
- Langlauf-Mietmaterial | Langlauf-Mietmaterial
- Ihre Apotheke Im Herzen Von Charlottenburg
- Interview: Marina Abramović | Marina Abramović
- Begleitschreiben_Final_Anonym , Begleitsatz E-Mail-Bewerbung: Vorlage, Beispiele, Tipps
- List Of Named Colors — Matplotlib 3.5.0 Documentation
- Wir Sind Klein Und Ihr Seid Alt: Ausflug Auf Den Bauernhof
- Assistenza Skype Per Skype Per La Tv
- 12 Week Functional Endurance Program
- Auth0.Android Save And Renew Tokens