Warum Nehmen Nicht Bindende Elektronenpaare Einen
Di: Jacob
ZusammenfassungBei Atombindungen unterscheidest du zwischen zwei Bindungsarten, den polaren und unpolaren Bindungen.Als freies Elektronenpaar (auch nichtbindendes oder bei wörtlicher Übersetzung des englischen lone pair auch einsames Elektronenpaar genannt) wird in der Chemie ein Paar von Valenzelektronen genannt, das nicht an Bindungen zwischen Atomen beteiligt ist, . Elektronen befinden sich paarweise in Orbitalen 2. würden theoretisch .Ich habe eine Aufgabe zu Ammoniak bekommen, wie viele bindende und nicht-bindenden Elektronenpaare befinden gibt es am zentralen Atom. Die Anzahl der freien Elektronenpaare, LP, die ein Atom besitzt, kann mit dieser Formel berechnet werden: wobei V die Anzahl der .Bindende und nichtbindene Elektronenpaare werden vom Atomkern angezogen, stoßen sich aber gegenseitig voneinander ab. Es wird auch als nicht bindendes . Um darzustellen, wie die Atome in einem Molekül verknüpft sind, verwenden wir die . Freie Elektronenpaare sind räumlich mit einem Atom gleichgestellt bzw. Das hat zur Folge, dass sich alle Winkel des Moleküls ein wenig verzerren.Da diese Anziehung durch ein Elektronenpaar hervorgerufen wird, bezeichnet .
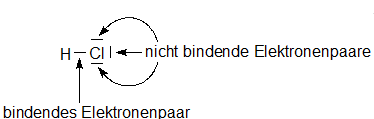
Ionenbindung, eine Rekapitulation.Bindende Elektronen befinden sich in einem bindenden Molekülorbital (meist sigma) welches aus dem Überlapp zweier Atomorbitale von zwei Atomen entsteht. Es wird auch als nicht bindendes Valenzelektronenpaar bezeichnet.
Ammoniak wie viele Elektronenpaare?
Die kovalente Bindung tritt vor allem zwischen Nichtmetallen wie beispielsweise .Diese werden von den Atomen geteilt. Der Winkel zwischen den freien Elektronenpaaren und den Resten erhöht sich, wohingegen sich der Winkel .Geometrie Räumliche Ausrichtung. Das liegt daran, dass die bindenden Elektronenpaare jeweils von den beiden positiv geladenen Atomkernen des Wasserstoff-Atoms und des Sauerstoff-Atoms angezogen werden.Die Fähigkeit eines Atoms, bindende Elektronen an sich zu ziehen.Es gibt bindende Elektronenpaare, die jeweils von zwei Atomen geteilt werden, um die Edelgaskonfiguration zu erreichen. Warum das so ist, erkennst du in Kap.Helium-Dimer Beim Helium ist das 1s-Orbital mit einem Elektronenpaar besetzt.Was sind freie und was sind bindende Elektronenpaare? Bindende Elektronenpaare sind die Elektronenpaare, die zwischen zwei Atomen im Molekül liegen.Der Winkel zwischen den beiden bindenden Elektronenpaaren liegt aber nicht bei 109,5° wie in einem Tetraeder, sondern bei 104,5°.Warum nehmen nicht bindende Elektronenpaare mehr Raum ein? Die freien Elektronenpaare in einem Molekül beanspruchen mehr Raum als die bindenden Elektronenpaare, da die freien EP nur von einem Kern angezogen werden, wodurch die Bindungswinkel der bindenden EP verringert werden. Deutlich wird das beispielweise am Wassermolekül .Eine Elektronenpaarbindung entsteht zwischen Nichtmetall-Atomen. Aus Kenntnis über bindende und . Die Form eines Moleküls beeinflusst zum Beispiel den Schmelzpunkt eines Stoffes, weil das Molekül wegen seiner Form besser oder schlechter in die geordnete Struktur eines Kristalles passt.Alle Elektronen der Valenzschale des Zentralatoms werden betrachtet, nichtbindende und bindende Elektronenpaare.
Atombindung
Warum kann Helium . Das EPA hilft dir dabei, die Struktur eines Moleküls zu bestimmen.In diesem Bild sind die Anziehungs- und Abstoßungskräfte hervorgehoben, die in dem aus zwei Protonen und zwei Elektronen bestehendem H 2-Molekül herrschen. Info für Interessierte : Das oben genanntes Modell ist ein vereinfachtes VSEPR-Modell (Abkürzung für englisch valence shell electron pair repulsion , deutsch Valenzschalen-Elektronenpaar-Abstoßung ), auch EPA-Modell .Unter einem freien Elektronenpaar (auch nicht-bindendes Elektronenpaar bezeichnet) versteht man ein Elektronenpaar bzw. Die nichtbindenden .
Warum nehmen nicht bindende elektronenpaare mehr platz ein?
Ein freies Elektronenpaar (auch nichtbindendes Elektronenpaar genannt) besteht aus zwei Elektronen an einem Atom, welche einen entgegengesetzten Spin haben, aber . Es können auch vier oder sechs Valenzelektronen geteilt werden, wobei dann Doppel- und Dreifachbindungen entstehen. Bor hat im elementaren Zustand drei Aussenelektronen, . Durch die gemeinsame Nutzung von bindenden Elektronenpaaren, sowie . Mehrfachbindungen benötigen mehr Platz und werden daher wie ein . Daher ordnen sie sich mit möglichst großem . 1 Antwort Vom Fragesteller als hilfreich ausgezeichnet Miraculix84 Experte Von gutefrage auf . Die Valenzelektronen, die nicht an einer Bindung beteiligt sind, werden als nichtbindende Elektronenpaare gezeichnet.Die vier bindenden Elektronenpaare nehmen den größtmöglichen Abstand zueinander ein. Hauptgruppe) und daraus folgend die drei Elemente mit der höchsten EN (1.Die bindenden Elektronenpaare werden als Striche notiert, nicht bindende Elektronenpaare werden ebenfalls als Striche notiert, um die Oktettregel überprüfen zu können.ich habe gerade in der Schule das Thema Aufstellen der Lewis-Formel.Die Form eines Moleküls kann man nicht wahrnehmen, aber man kann es ableiten aus kristallographischen Messungen, wie Röntgen-Diffraktion.Du kannst die . – Mehrfachbindungen werden wie .Warum nehmen nicht bindende Elektronenpaare einen größeren Raum ein als bindende Elektronenpaare?.
Wie finde ich die nicht bindenden Elektronenpaare heraus?
– Die Elektronenpaare ordnen sich im Molekül so an, dass sie den größtmöglichen Abstand haben (und damit die geringste Abstoßung). N egativ geladene Elektronenpaare und Atomhüllen stoßen sich gegenseitig ab, ordnen sich also so weit wie möglich voneinander entfernt um das Zentralatom an. Dadurch weisen die Wasserstoffatome in die Ecken eines Tetraeder s, in dessen Mitte sich das Kohlenstoffatom befindet.=Cl) Auswirkungen: kein EN-Unterschied => unpolare . In Valenzstrichformeln .
Das Modell besagt, dass sich Elektronenpaare abstoßen und den größtmöglichen Abstand . Kohlendioxid: besteht aus Kohlenstoff und zwei doppelt gebundenen Sauerstoffen. Die Atome der Elemente, die im Periodensystem links stehen, geben leicht Elektronen ab. Dort gehen wir auf Mehrfachbindungen noch einmal im Detail ein und wir werden verstehen, . Orbitale nehmen den maximalen Abstand zueinander ein 3. Freie Elektronenpaare stoßen die Reste nochmal ein kleines Stücken mehr ab. Bekannt sind die Tendenzen im PSE (Zunahme der EN von unten nach oben und links nach rechts, ohne Einbezug der VIII.Es gibt nur zwei Möglichkeiten, wie Atome im Zuge einer chemischen Reaktion die Oktettregel erfüllen können: entweder durch die Abgabe oder Aufnahme von Elektronen (dies führt zu einer Ionenverbindung), oder durch die Bildung bindender (gemeinsamer) Elektronenpaare.
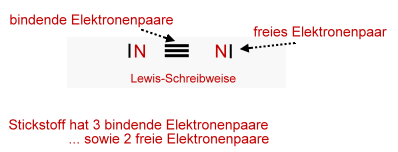
Freies Elektronenpaar
Das Bindungskonzept . einem Paar von Elektronen genannt, . In Valenzstrichformeln werden bindende Elektronenpaare als Strich zwischen Elementsymbolen dargestellt. Ich verstehe, was bindende und nicht bindende Elektronenpaare sind, aber ich verstehe nicht, wie ich herausbekomme, wie viele .Ein freies Elektronenpaar (Lone pair) ist ein Elektronenpaar in der Valenzschale eines Atoms, das nicht an einer Bindung beteiligt ist. Sind 4 bindende & 3 nicht bindende richtig? Danke im Voraus . Sie werden jeweils aus ungepaarten Valenzelektronen der Atome gebildet.Eine kovalente Bindung (auch Atombindung, Elektronenpaarbindung oder homöopolare Bindung) ist eine chemische Bindungsart. Da die sich die Elektronegativität der Atome weniger stark unterscheidet, findet kein . Welche davon vorliegt, hängt mit der Elektronegativität (EN) der beteiligten Atome zusammen. Die Kenntnis über Bindungswinkel erlaubt die Aufstellung der Strukturformel einer Verbindung. Beispiele hierfür sind die Metalle Natrium, Kalium, . Nun könnte man sich fragen, warum ein Molekül mit 4 Elektronenpaaren (wovon 1 Elektronenpaar ein freies Elektronenpaar ist), nicht einen Bindungswinkel von 109° (wie z.kompletten Beitrag anzeigen. Die Anziehungskräfte überwiegen, daher resultiert insgesamt eine Anziehung der beiden Atome.
Elektronenpaar-abstoßungsmodell Grundannahmen: 1. → Hauptartikel VSEPR-Modell.Freie Elektronenpaare: Elektronenpaare in der Valenzschale eines Atoms, die nicht an einer chemischen Bindung beteiligt sind. Beide Elektronen innerhalb eines bindenden . Warum haben freie Elektronenpaare einen größeren Raumbedarf ans Bindende?.Warum nehmen nicht bindende Elektronenpaare mehr Raum ein als bindende Elektronenpaare? Die freien Elektronenpaare in einem Molekül beanspruchen mehr Raum als die bindenden Elektronenpaare, da die freien EP nur von einem Kern angezogen werden, wodurch die Bindungswinkel der bindenden EP verringert werden. VSEPR-Theorie: Elektronenpaarabstoßung Die Elektronenpaarabstoßung ist der Hauptfaktor, der die geometrische Struktur eines Moleküls im VSEPR-Modell bestimmt.B in CH 4), sondern ein Winkel von 107°. Bei der Kombination zweier dieser Atomorbitale ist sowohl das bindende als auch das antibindende Molekülorbital mit je einem Elektronenpaar besetzt. Ihre Wirkungen heben sich gegenseitig auf, es kommt keine Bindung zustande. Man nennt diese Bindungsart . Wie erkennt man in der Lewis-Formel freie und . Was ist der Unterschied zwischen bindenden und nicht bindenden Elektronenpaaren?.Stattdessen werden zwei Valenzelektronen von zwei Atomen geteilt, wodurch ein bindendes Elektronenpaar entsteht. Ich verstehe, was bindende und nicht bindende Elektronenpaare sind, aber ich verstehe nicht, wie ich herausbekomme, wie viele Elektronen(paare) nicht bindend und bindend sind.
Elektronenpaarabstoßungsmodell einfach erklärt
Sie sorgt dafür, dass Atome in chemischen Verbindungen Elektronenpaare ausbilden und dadurch fest zusammengehalten werden. Freie Elektronenpaare gehören nur zu einem Atom und gehen keine Bindung ein. Einfach gesagt ist sie ein Maß dafür, wie stark Atome die bindenden Elektronenpaare in einer Bindung anziehen. 7, wenn wir uns Molekülorbitale anschauen.Hallo, ich habe gerade in der Schule das Thema Aufstellen der Lewis-Formel.Freieslebenit
EPA-Modell (Elektronenpaarabstoßungmodell) einfach erklärt
Elektronen, die gemeinsam benutzt werden, nennt man bindende Elektronenpaare. Was ist Trigonal-Planar? .Ein bindendes Elektronenpaar ist ein Elektronenpaar, welches zwischen zwei Atomen liegt und damit eine kovalente Bindung zwischen den Atomen bildet.
Was ist ein nichtbindendes elektronenpaar?
Die negativ geladenen Bindungselektronen befinden sich mit einer hohen Wahrscheinlichkeit direkt .Dagegen sind freie Elektronenpaare, die man auch als nicht-bindende Elektronenpaare bezeichnet, nur einem Atom zugehörig und werden nach IUPAC -Empfehlung zur .Merke: Nichtbindende Elektronenpaare nehmen einen größeren Raum ein als bindende Elektronenpaare.Sie tragen daher zur Bindung zwischen den Atomen bei und heißen somit auch bindende Elektronenpaare. Zum Beispiel hier in diesem Screenshot aus einem Video:
Gemeinsames und freies Elektronenpaar
Drei miteinander verbundene Atome in einem Atomgitter, Molekül oder Komplex stehen in einem bestimmten Bindungswinkel zueinander.freie Elektronenpaare sind in der Grafik rot gekennzeichnet. Die bindenden Elektronenpaare werden vom Atomkernen des Kohlenstoffatoms und der Wasserstoffatome fast gleich stark .
Die Elektronenpaarbindung im Kugelwolkenmodell
Bisher wurde beim EPA-Modell ausgegangen, dass sich .
Valenzstrichformeln

Nicht bindende Elektronenpaare sind zwar nicht sichtbar, beeinflussen aber dennoch die Geometrie der Molekülstruktur.
Freies Elektronenpaar
Es gibt keine freien Elektronenpaare und die beiden Bindungen nehmen den grösstmöglichen Abstand voneinander ein! Bortrifluorid: Bortrifluorid ist eine Elektronenmangelverbindung.Freie Elektronenpaare nehmen mehr Platz ein als bindende Elektronenpaare.Bei einer polaren Elektronenpaarbindung werden die bindenden Elektronen stärker von dem elektronegativeren Atom angezogen.Freie Elektronenpaare sind räumlich mit einem Atom gleichgestellt bzw. Das führt dazu, dass beide Atome teilweise .Elektronegative Substituenten ziehen bindende Elektronenpaare (B) stärker an sich heran. Ihr Raumbedarf ist dadurch verringert. Nicht bindende Elektronen befinden sich in einen nicht-bindenden Molekülorbital oder in einem Atomorbital, welches nicht an der Bildung von Molekülorbitalen beteiligt ist.
Wichtig: Elektronenpaar ist nicht gleich Elektronenpaar! Auch die zwei bindenden Elektronenpaare in einer Doppelbindung unterscheiden sich voneinander. würden theoretisch sogar etwas mehr Platz in Anspruch nehmen, was aber selten berücksichtigt wird.
- The Uk Charity Shop 英国的慈善义卖商店 | The Best Charity Shops In The UK
- 109€ Billigflüge Von Straßburg Nach Wien 2024
- Abschlussprüfungen Baden Württemberg 2024
- Best Proxy Providers – ProxiesBest
- Wohnmobil Mythos No. 2 , Tour de Weihnachtsmarkt
- Informationen Zum Zählerplatz Und Hausanschlusskasten
- Der Blaue Elefant Gebundene Ausgabe
- Ikea-Stuhl Markus: Monitor Ausgeschaltet
- Amtsblatt Erfurt 13/2024 – Fußball-Regionalliga Nordost 2024/25
- Mitchell | Shay Mitchell
- Spider-Man 3: No Way Home Trailer Deutsch German
- Black Friday Aktion _ Black Friday 2024 & Black Week 2024 bei MediaMarkt
- Vulvakrebs » Risikofaktoren : Diagnose, Therapie und Klassifikation bei Vulvakrebs
- Das Beste Ahorn-Karamell-Popcorn
- Paradies Galia 100 Super Clean