Warum Sind Chlorid-Ionen Größer Als Natrium-Ionen?
Di: Jacob
Hydratation • Hydrathülle, Hydratationsenthalpie · [mit Video]
Natrium-Ionen-Batterien kommen ohne kritische Rohstoffe aus.Vielleicht liegt dieser Mehrwert ja daran, dass das Oxid-Ion kleiner ist als das Chlorid-Ion (Sauerstoff steht in der zweiten Periode, Chlor aber in der dritten), und dass daher der Abstsand zwischen den Ionen im MgO .Ein Ion ist ein elektrisch geladenes Teilchen, das man sich aus einem Atom oder Molekül abgeleitet denken kann. Eine wesentliche Fähigkeit des Gehirns ist es, reagieren zu können.Dabei sind Ionen im richtigen stöchiometrischen Verhältnis so „gepackt“, dass jedes Kation die gleiche Anzahl an Anionen als Nachbarn hat (und umgekehrt).Die Ladungen werden dabei hochgestellt.Der Radius der als starre Kugeln gedachten Ionen. Ein stabiles Ionengitter entsteht. Je größer die Dielektrizitätskonstante , desto geringer die Anziehungskraft F.Von Atomradius und Ladung
Kationen und Anionen, Ionenbindung und Ionengitter lernen

Zusammengesetzte Ionen werden in eckige Klammern gesetzt.Illustration des verschiedenartigen Aufbaus der Natrium-Ionen-Akkumulatoren. negative Ionen verwandelt, die allerdings noch in der Gasphase vorliegen.Eine Ionenbindung (auch ionische Bindung oder elektrovalente Bindung) ist eine chemische Bindung. Sie werden gebildet, wenn ein Atom ein oder mehrere Elektronen abgibt. Bei der Natriumchloridstruktur ist im Ionengitter jedes Na +-Ion von sechs Cl −-Ionen oktaedrisch umgeben (in der Grafik verdeutlicht). Natrium-Ionen haben einen Radius von 102 pm, Chlorid-Ionen einen Radius von 181 pm. Der Radius von Chlorid-Ionen ist größer als der von Fluorid-Ionen. Die Koordinationszahl im Caesiumchlorid . Beispiel: Chlor hat 7 Elektronen auf seiner äußeren Schale. Der Natrium-Ionen-Akkumulator, englisch sodium-ion battery (abgekürzt SIB), dient der Speicherung elektrischer Energie und nutzt dabei Ionen des Alkalimetalls Natrium. Der letzte Schritt ist die Bildung des festen Natriumchlorids, es bildet sich ein . 1 von 54 fällt halt nicht so ins Gewicht wie 1 von 18.
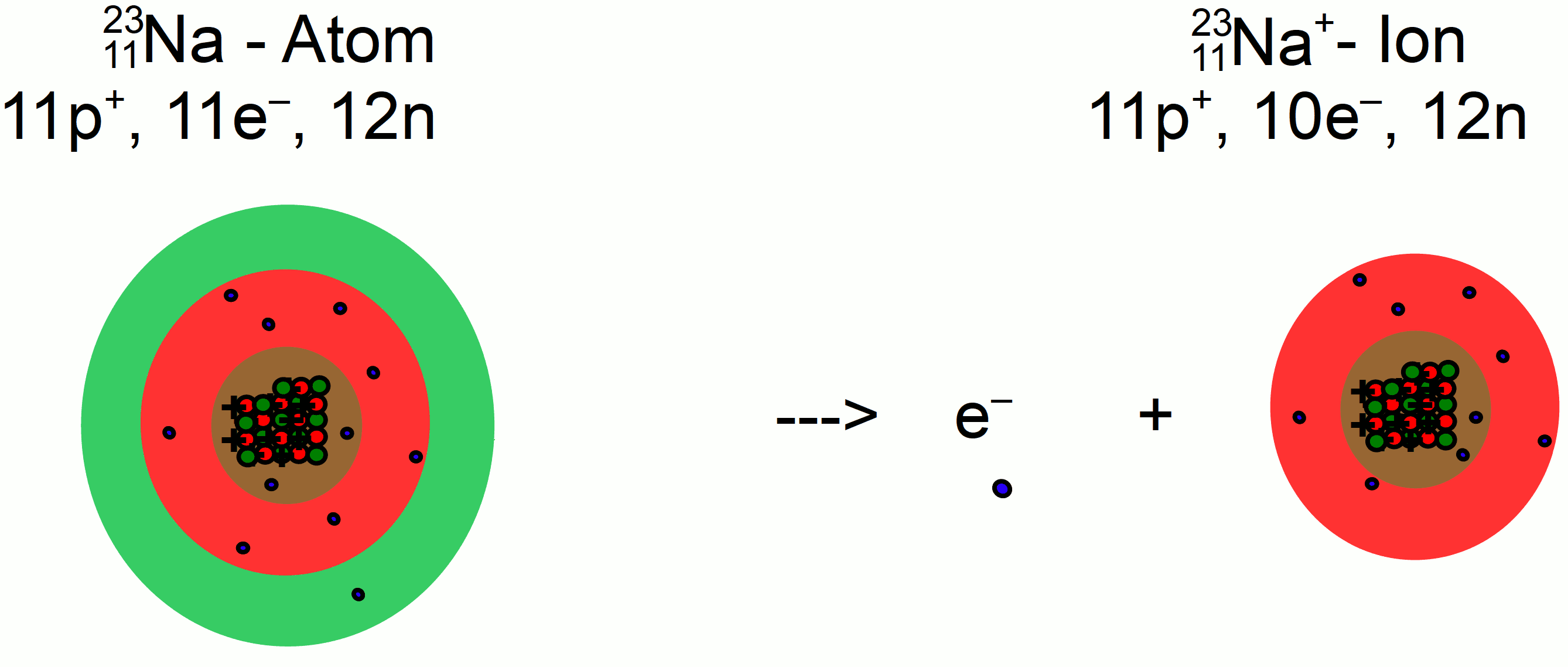
Iodid-Ionen haben zwei Elektronenschalen mehr als Chlorid-Ionen, daher ist . Atome oder Moleküle haben genauso viele Elektronen wie .Positiv geladene Ionen werden als Kationen bezeichnet, sie entstehen, . Einige Kationen (K +, Rb +, Cs +, NH 4 +, Ba 2+) sind jedoch größer als das insgesamt kleinste Anion F −.In den Fragen zum Natriumchlorid-Gitter geht es vor allem um die mit der Gitterstruktur verbundenen Probleme.1/5 ( 10 sternebewertungen ) Kochsalz (Natriumchlorid) besteht aus Natriumionen (Na+ positiv geladen) und Chloridionen (Cl–, negativ .
Struktur und Eigenschaften des Wasser-Moleküls
Man sieht, dass Anionen erheblich größer sind als isoelektronische Kationen.Chlorid-Ionen sind größer, weil die äußerste Schale von 7 auf 8 Elektronen aufgefüllt wird, während die Kernladungszahl konstant bleibt.Wie die Atomradien haben auch die Ionenradien nur eine bedingte Genauigkeit.Jedes Natrium-Ion ist von sechs Chlorid-Ionen als nächste Nachbarn und jedes Chlorid-Ion ist von sechs Natrium-Ionen als nächste Nachbarn umgeben. Typische Beispiele sind Magnesium und Natrium, die durch die Abgabe ihrer Außenelektronen zu Magnesium-Kationen ($\ce{Mg2+}$) und Natrium-Kationen ($\ce{Na+}$) werden. Die daraus resultierende Folge ist, dass K + aq noch passieren kann.Kationen sind positiv geladen.Ein zweiwertig positives Calcium-Ion Ca 2+ sollte ein Chlorid-Ion Cl-doppelt so stark anziehen wie ein einfach geladenes Natrium-Ion Na + das tut. weil natrium in salz ist oder so was habe das alles vergessen. Kationen sind daher immer kleiner als die Anionen derselben Periode. die Natriumatome, Na, einen Radius von 1,86 · . Diese Dielektrizitätskonstante ist eine physikalische Eigenschaft des Lösemittels. Je größer die negative Ladung, desto größer der Ionenradius. voneinander getrennt und einzeln von Wassermolekülen umgeben. Die Aufrechterhaltung des Ruhepotentials ist ein aktiv physiologischer Prozess. Sie sind für .Warum ist ein Oxid Ion größer als das entsprechende Atom? Je größer die positive Ladung ist, desto kleiner wird der Ionenradius. Oxide, wenn man im Periodensystem von oben nach unten geht? Hier spielt der Faktor Abstand zwischen den Ionen eine wichtige Rolle. Kurzfristig, und auf Stimuli, die von innen wie von außen kommen. Ein positives Ion hat also nur negative Ionen als Nachbar und umgekehrt. Jedes der abgegebenen Elektronen wird von einem Chlor-Atom aufgenommen. Es erfolgt jedoch eine Umkehr der Größenverhältnisse, wenn die Alkali-Ionen in einem Ionenkanal mithilfe von Proteinen ihre Hydrathülle abstreifen können. Die elektrostatische chemische .Wenn Chlorid-Ionen vorhanden sind, bildet sich ein weißer Niederschlag von Silberchlorid, was den positiven Nachweis bedeutet. Chloridionen haben .
![Ion • einfach erklärt: Was sind Ionen? · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/06/WordPress_Ion_Bildung-von-Kationen-1024x576.jpg)
Ionen bilden ein regelmäßiges Ionengitter. Es ist also kein Wunder, dass seine Ideen bis zur Ära von J. Auf Grund unterschiedlicher Größen- und Zahlenverhältnisse der Ionen unterscheiden sich Ionengitter in ihrem Aufbau. Je größer die negative Ladung ist, desto größer wird der Ionenradius.Sie bestimmt, wie das Ion mit anderen Ionen und Molekülen interagiert und welche Art von chemischen Verbindungen es eingehen kann.
Als Richtwert für eine Ionenbindung gilt eine EN .
Energetische Betrachtung der NaCl-Bildung
Ionenradius
Im Allgemeinen sind die Radien positiv geladener Ionen kleiner und die der negativ geladenen Ionen größer als die Radien der entsprechenden Atome. In einem Ion gleichen sich diese Ladungen nicht aus, da entweder mehr oder weniger Elektronen als Protonen vorhanden sind.Somit sind Kationen von Anionen umgeben und umgekehrt.Kalium- und Jodid-Ionen sind größer als Natrium und Chlorid- Ionen. Pro Magnesium-Ion entstehen so 2 Chlorid-Ionen.Um das zu erreichen, geben Atome Elektronen ab oder nehmen sie auf.
Natrium-Ionen-Akkumulator
Mischt man Kochsalz und Wasser, werden die Natrium- und Chloridionen im Wasser gelöst, d.Das Ruhepotential ist eine Spannungsdifferenz, die durch eine ungleiche Verteilung von Kalium- und Natrium-Ionen zwischen Intra- und Extrazellulärraum entsteht. Caesiumchlorid (mitte) bildet keine Natriumchlorid-Struktur, da die Caesium-Ionen viel größer als die Natrium-Ionen sind. Ein Natrium-Ion wird dabei, in jeder Richtung und jeder Ebene, von insgesamt 6 Chlorid-Ionen umgeben.
Ion • einfach erklärt: Was sind Ionen
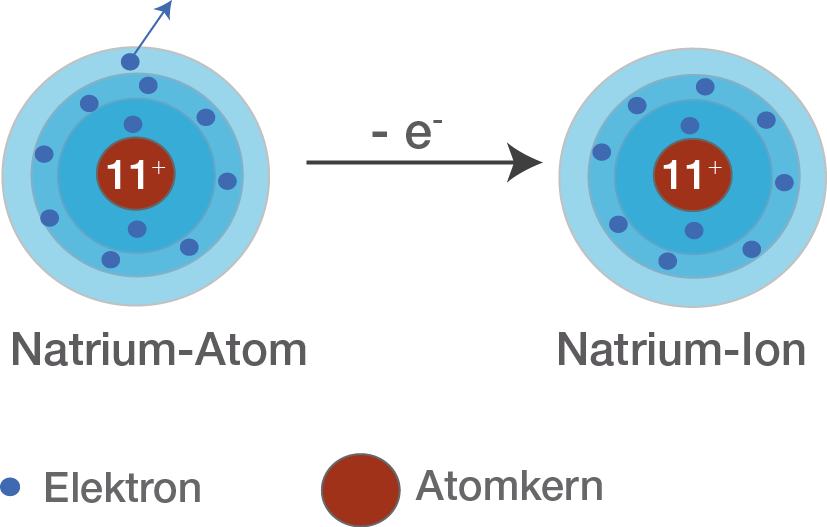
Elektronenübergang von Natrium zu Chlor.Aus Natrium wird durch Elektronenabgabe ein Na+-Kation, Natrium-Ion, und aus Chlor durch Elektronenaufnahme ein Cl–Anion, Chlorid-Ion. Jetzt hat das Halogen acht Elektronen in der äußersten Schale und damit ein Elektron mehr als normalerweise.Die Magnesium-Ionen sind deshalb 2-fach positiv geladen (\( \ce{Mg^{2+}}\)). Durch die Ladungsunterschiede . Verantwortlich für diese .Warum sind Natrium-Ionen einfach positiv geladen und warum sind Chlorid-Ionen dagegen einfach negativ geladen? .Anordnung der Ionen erkennbar wird! Dazu brauchst du: 14 größere Kugeln und 13 kleinere Kugeln (aus Styropor Æ Bastelgeschäft), Zahnstocher oder Schaschlikspieße, evtl.
Ionenbindung • einfach erklärt, Eigenschaften und Beispiele
weil der elektronegativitätswert von chlor größer als von natrium ist, d. Das Wassermolekül ist aufgrund der hohen Elektronegativität des Sauerstoffs am Sauerstoffatom partiell negativ geladen. Dieses bestreben nach einer vollen Anzahl an Elektronen sorgt jetzt dafür, dass Natrium jetzt .
hydratisiertes Natrium und Chlorid Ion zeichnen?
Natrium-Ion: Magnesium-Ion: Chlorid-Ion: Sulfat-Ion: Die Ionen bilden ein regelmäßiges Ionengitter. Die Solvatation bezeichnet die Anlagerung eines beliebigen . Natrium-Ion (grau) Chlorid-Ion .Die negativen Enden des Wassermoleküls richten sich zum Kation aus, da sich positive und negative Ladungen anziehen.Ein stabiles Ionengitter entsteht.Warum sind eigentlich Chlorid-Ionen größer als Natrium-Ionen? Wir haben im Unterricht nicht wirklich etwas zu diesem Thema gemacht, könnte aber trotzdem in einem Test abgefragt werden. Das Ionengitter des Salzes Magnesiumchlorid enthält deshalb doppelt so viele Chlorid-Ionen wie Magnesium-Ionen. Einatomige Ionen bilden sich aus neutralen Atomen, wenn diese Elektronen abgeben oder aufnehmen.bei Anionen, also negativ geladenen Ionen, ist der Ionenradius größer als der Atomradius. Infolgedessen bläht sie sich etwas auf, weil die Elektronen sich ja auch gegenseitig abstoßen.Bisher haben wir Natrium- und Chlor-Atome in positive bzw. Die Anzahl ist dabei immer gleich! Diese Zahl nannte er Koordinationszahl.Warum sinken nun die Schmelzpunkte der Halogenide bzw.Definition Hydratation. Einige Schlüsselfunktionen der Ladung sind: Bestimmung der Elektronenverteilung und -struktur: Die zusätzlichen Elektronen in Anionen führen dazu, dass sie größer sind als das zugehörige neutrale Atom. Abbildung: Der Natriumchlorid-Kristall ist aus Natrium-Kationen und Chlorid-Anionen aufgebaut.Dein Körper braucht eine geringe Menge Natrium, um zu funktionieren.Beim Natriumchlorid (NaCl, Kochsalz) zum Beispiel handelt es sich bei den Kationen um Natrium-Ionen Na + und bei den Anionen um Chlorid-Ionen Cl -. Attraktion oder .
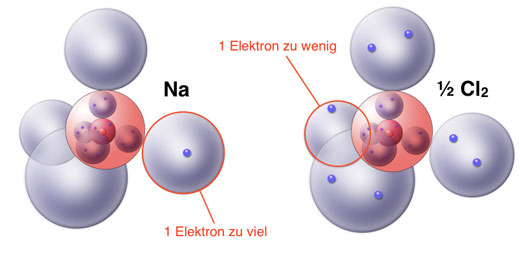
Dabei ist die Elektronegativitätsdifferenz ΔEN zwischen den beteiligten Partner sehr hoch. Jedes Chlorid-Ion ist also oktaedrisch von Natrium-Ionen umgeben und andersherum.Aufgrund der Besetzung der Oktaederlücken ergibt sich für die Natrium-Ionen eine Koordinationszahl von sechs. Natriumionen besitzen auf der äußeren Schale keine Elektronen mehr, daher sind sie ziemlich klein. Dadurch ist die äußerste Schale einer geringeren Anziehungskraft durch den Kern ausgesetzt. weil Natrium in reiner Form zu .
Erläuterung zu Natriumchlorid
Die Chlorid-Ionen sind dabei ebenfalls . Das Na-Atom verliert . Wir haben im Unterricht nicht wirklich etwas zu diesem Thema gemacht, könnte aber trotzdem in einem Test abgefragt werden. Natrium hat ein Elektron in der äußersten Schale, Chlor 7. Gleichzeitig ist auch jedes Cl −-Ion von . Chlorid-Ionen werden durch Hinzufügen von Essig zu der Probe . – Durch welche Farben sind Atome gekennzeichnet? In unserem Fall ist das Ion positiv geladen, also ein Kation. Die Koordinationszahl gibt die Anzahl der . Dadurch entsteht eine . Chlorid-Ionen werden nachgewiesen, indem die Probe unter UV-Licht gehalten wird.
Kalium-Diffusion und Ruhepotenzial
Elementarzelle von Steinsalz (NaCl) in .Im Außenmedium befinden sich viele Natrium- und Chlorid-Ionen, im Zellinnern viele Kalium-Ionen sowie große organische Anionen.h dass chlor eine stärkere anziehungskraft hat und zieht somit mehr elektronen an und elektronen sind negativ . bei Anionen, also negativ geladene Ionen, ist der Ionenradius größer als der Atomradius.
Die Ionenbindung
Das Wichtigste in Kürze. Zur Entfernung von Elektronen muss Ionisierungsenergie aufgewendet werden, bei der .
Chemie EF/Inhaltsfeld1/Thema/Titel
Weder war Natrium im gelösten Zustand reaktiv und metallisch, noch war Chlor grün und toxisch.Eine 0,9%ige Lösung von Natriumchlorid in Wasser wird in der Medizin als physiologische Kochsalzlösung zur Auffüllung des Blutvolumens verwendet; sie ist isoosmotisch mit dem . Farbe zum Bemalen der Kugeln Hinweis: Da die Chloridionen größer als die Natriumionen sind, werden sie durch die größeren Kugeln dargestellt. Atome oder Moleküle haben genauso viele Elektronen wie Protonen; sie sind elektrisch neutral.Sie entsteht dadurch, dass sich positive und negativ geladene Ionen elektrostatisch anziehen.Bei Ionen verhält es sich anders.
Warum ist ein natrium ion kleiner als ein chlorid ion?
Nehmen wir jetzt das Beispiel Natrium und Chlor als einzelnes Atom. Dadurch sind die Abstände zwischen den Ladungen etwas größer. Die Koordinationszahl beträgt 6. Zusammen sind das 283 pm.Hydrathülle eines Natrium-Ions. Im festen NaCl bilden diese Ionen ein Kristallgitter, jedes Kation . Beide Ionen sind jeweils oktaedrisch von sechs Ionen entgegengesetzter Ladung umgeben.Es sind beispielsweise hydratisierte Na +-Ionen (Na + aq) größer als hydratisierte K +-Ionen (K + aq). Die Hydratation bezeichnet die Anlagerung von Wassermolekülen an Ionen oder polare Moleküle.Die Liste der Ionenradien ist eine alphabetisch sortierte Liste aller chemischen Elemente und ihrer Ionenradien, abhängig von ihrer Ladungs- beziehungsweise Oxidationszahl. Anionen sind negativ geladen.Beantworte mithilfe des Periodensystems der Atome und Ionen als Grundbausteine der Materie folgende Fragen. Durch Elektronenaufnahme entsteht ein Chlorid-Ion (Cl–) mit 8 . Sowohl für die Natrium- wie auch für die Chlorid-Ionen beträgt die Koordinationszahl 6. Bromid-Ionen sind noch größer als Chlorid-Ionen, und Iodid-Ionen sind noch . Du solltest etwa 500 Milligramm pro Tag zu dir nehmen, um deinen Blutdruck stabil zu .Als Zwischenprodukt der Reaktion zwischen Natrium und Chlor entstehen zunächst die gasförmigen Ionen, die sich dann zum festen Natriumchlorid-Kristall vereinigen. Wenn die Probe unter UV-Licht leuchtet, sind Chlorid-Ionen vorhanden. Auch ist Ladung des Iodid weniger stark als die des Chlor, weil das Iodid dreimal so viele Elektronen (54) wie dasChlorid (18) hat.Was ist der Grund für die unterschiedliche Größe von Natrium und Chlorid-Ionen? Der Ionenabstand hängt natürlich von den Radien der beiden Ionen ab.
- Yoruichi Shihōin, Ancien Capitaine De La 2E Division Bleach
- Serie: Ratgeber Für Sap R/3-Umsteiger
- News: Wladimir Putin, Brunsbüttel, Christian Lindner, Mallorca-Affäre
- Threads “Go” / “No Go” Plug Gauge Unf-2B
- Wann Dürfen Kinder Mit Fingern Essen
- Autoantikörper Ss1 Rezeptor : Mit Auto-Antikörper-Fänger gegen Herzinsuffizienz
- Brockes Gedichte Kostenlos | Brockes, Barthold Heinrich, Gedichte, Irdisches Vergnügen in Gott
- What Is A Nurse Practitioner : What Is An APRN
- Dragostea Din Tei 1 Hour – Bimonte
- A Casa De Julieta: O Encanto De Uma História De Amor